Différence entre l'oxygène et le dioxyde de carbone
Le différence clé entre l'oxygène et le dioxyde de carbone est que L'oxygène est une molécule diatomique ayant deux atomes d'oxygène tandis que le dioxyde de carbone est une molécule triatomique ayant un atome de carbone et deux atomes d'oxygène.
Les gaz d'oxygène et de dioxyde de carbone sont deux constituants cruciaux dans l'atmosphère terrestre. Cela est dû à son importance pour les organismes vivants. De même, nous avons besoin d'oxygène pour la respiration et les émissions de dioxyde de carbone pendant le processus de respiration. Nous avons besoin de cet oxygène inhalé pour produire de l'énergie (ATP) à l'intérieur des cellules vivantes du processus connu sous le nom de respiration cellulaire. D'un autre côté, les plantes utilisent du dioxyde de carbone pour la photosynthèse pour produire des glucides. Ainsi, les plantes impliquent le maintien de l'oxygène, l'équilibre du dioxyde de carbone dans l'atmosphère.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxygène
3. Qu'est-ce que le dioxyde de carbone
4. Comparaison côte à côte - oxygène vs dioxyde de carbone sous forme tabulaire
5. Résumé
Qu'est-ce que l'oxygène?
L'oxygène gazeux est un gaz diatomique ayant deux atomes d'oxygène liés les uns aux autres via une double liaison. Ces deux atomes d'oxygène se lient entre eux via une liaison chimique covalente. Par conséquent, la molécule d'oxygène est un composé moléculaire (ou un composé covalent). À la température et à la pression standard, ce composé existe à l'état gazeux.
De plus, notre atmosphère contient environ 21% de ce gaz. Et, c'est incolore et inodore. Il est très important pour la vie sur Terre car nous utilisons ce gaz pour la respiration cellulaire. De plus, les atomes d'oxygène sont des composants essentiels dans les systèmes biologiques inclus dans les bio-molécules telles que les glucides, les protéines et les acides nucléiques.
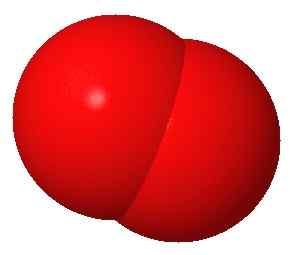
Figure 01: molécule d'oxygène diatomique
La photosynthèse, en revanche, est un processus important dans lequel les plantes utilisent l'énergie de la lumière du soleil pour produire des glucides et de l'oxygène à partir de l'eau et du dioxyde de carbone. Un allotrope d'oxygène, l'ozone, fait une couche à la haute atmosphère qui peut nous protéger des rayons UV nocifs.
En bref, il existe plusieurs caractéristiques favorables de ce gaz; Il se dissout facilement dans l'eau, ce qui facilite le transport dans tout le corps humain via des fluides corporels. De plus, nous pouvons obtenir l'oxygène gazeux de haute pureté à partir de la distillation fractionnée de l'air liquéfié. Ce gaz réagit avec tous les éléments pour former des oxydes à l'exception des gaz inertes. Par conséquent, c'est un bon agent oxydant. L'oxygène est également essentiel pour la combustion. L'oxygène est utile dans les hôpitaux, le soudage et dans de nombreuses autres industries.
Qu'est-ce que le dioxyde de carbone?
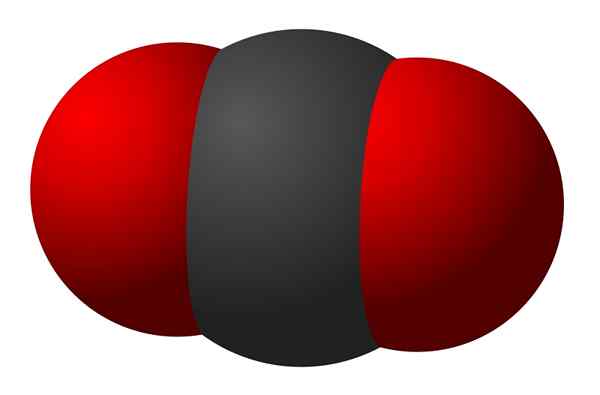
Le dioxyde de carbone est une molécule triatomique ayant un atome de carbone et deux atomes d'oxygène. Chaque atome d'oxygène forme une double liaison avec le carbone. D'où la molécule a une géométrie linéaire. Le poids moléculaire du dioxyde de carbone est de 44 g mole-1. La formule chimique est co2, Et c'est un gaz incolore. De plus, lors de la dissolution dans l'eau, il forme de l'acide carbonique. Plus important encore, ce gaz est plus dense que l'air. La concentration de dioxyde de carbone est 0.03% dans l'atmosphère.

Figure 02: molécule triatomique du dioxyde de carbone
Cependant, la quantité de dioxyde de carbone dans l'atmosphère équilibre son contenu dans l'atmosphère à travers le cycle du carbone. Les sources de ce gaz qui l'émettent dans l'atmosphère comprennent certains processus naturels tels que la respiration, l'éruption du volcan, ainsi que par des activités humaines comme le combustible fossile des véhicules et des usines. De plus, le processus de photosynthèse élimine le dioxyde de carbone de l'air, et donc, il se dépose sous forme de carbonates à long terme.
L'interférence humaine (combustion de combustibles fossiles, déforestation) provoque un déséquilibre dans le cycle du carbone, augmentant le CO2 niveau de gaz. Des problèmes environnementaux mondiaux comme les pluies acides, l'effet de serre, le réchauffement climatique ont résulté de cela. Ce gaz est utile pour faire des boissons gazeuses, dans l'industrie de la boulangerie, comme extincteur, etc.
Quelle est la différence entre l'oxygène et le dioxyde de carbone?
L'oxygène gazeux est un gaz diatomique ayant deux atomes d'oxygène liés l'un à l'autre via une double liaison tandis que le dioxyde de carbone est une molécule triatomique ayant un atome de carbone et deux atomes d'oxygène. Par conséquent, la principale différence entre l'oxygène et le dioxyde de carbone est que l'oxygène est une molécule diatomique ayant deux atomes d'oxygène tandis que le dioxyde de carbone est une molécule triatomique ayant un atome de carbone et deux atomes d'oxygène. De plus, la formule chimique de l'oxygène gazeux est O2 tandis que la formule chimique du dioxyde de gaz est CO2.
En dehors de cela, une autre différence importante entre l'oxygène et les gaz de dioxyde de carbone est que la teneur en oxygène dans l'air est relativement très élevée (21%) que la teneur en dioxyde de carbone (0.03%). Comme autre différence importante entre ces deux gaz, nous pouvons jouer le rôle de chaque gaz dans le processus de respiration; Nous inhalons l'oxygène gazeux tout en expirant du dioxyde de dioxyde.

Résumé - Oxygène vs dioxyde de carbone
L'oxygène et le dioxyde de carbone sont des composants gazeux dans l'air de l'atmosphère. La principale différence entre l'oxygène et le dioxyde de carbone est que l'oxygène est une molécule diatomique ayant deux atomes d'oxygène tandis que le dioxyde de carbone est une molécule triatomique ayant un atome de carbone et deux atomes d'oxygène.
Référence:
1. "Oxygène.»Wikipedia, Wikimedia Foundation, 26 octobre. 2018. Disponible ici
2. "Gaz carbonique.»Wikipedia, Wikimedia Foundation, 7 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Molecule d'oxygène» par Ulflund - Propre travaux, (CC0) via Commons Wikimedia
2.«Carbon-dioxyde-3d-vdw» par Jacek FH - propre travail (CC BY-SA 3.0) via Commons Wikimedia


