Différence entre le potentiel d'oxydation et le potentiel de réduction
La principale différence entre le potentiel d'oxydation et le potentiel de réduction est que Le potentiel d'oxydation indique la tendance d'un élément chimique à être oxydé. En revanche, le potentiel de réduction indique la tendance d'un élément chimique.
Le potentiel d'oxydation et le potentiel de réduction sont deux types de valeurs de potentiel d'électrode pour les espèces chimiques données en volts dans des conditions standard. Par conséquent, nous les nommons potentiel d'oxydation standard et potentiel de réduction standard. La valeur de ces potentiels détermine la capacité d'une espèce chimique particulière à subir une oxydation / réduction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le potentiel d'oxydation
3. Qu'est-ce que le potentiel de réduction
4. Comparaison côte à côte - potentiel d'oxydation vs potentiel de réduction de la forme tabulaire
5. Résumé
Qu'est-ce que le potentiel d'oxydation?
Le potentiel d'oxydation est une valeur qui indique la tendance d'une espèce chimique à être oxydée. En d'autres termes, c'est la capacité d'une électrode à perdre des électrons (à s'oxyder). Habituellement, cette valeur est donnée dans des conditions standard; Par conséquent, nous devons le nommer comme un potentiel d'oxydation standard. La dénotation pour ce terme est SOP. Il est mesuré en volts. Et, cela est très similaire au potentiel de réduction standard, mais ils sont différents dans le signe de la valeur, je.e. La valeur du potentiel d'oxydation standard est la valeur négative du potentiel de réduction standard. Nous pouvons écrire le potentiel d'oxydation comme une demi-réaction. La formule générale pour une réaction d'oxydation et le potentiel d'oxydation du cuivre sont donnés ci-dessous:

Demi-réaction de l'oxydation du cuivre: Cu(S) ⟶ Cu2+ + 2E-
La valeur du potentiel d'oxydation standard pour la réaction ci-dessus (oxydation du cuivre) est de -0.34 V.
Qu'est-ce que le potentiel de réduction
Le potentiel de réduction est la tendance d'une espèce chimique particulière à subir une réduction. Cela signifie; Cette espèce chimique particulière est disposée à accepter les électrons de l'extérieur (pour être réduits). Il est mesuré en volts et généralement mesuré dans des conditions standard. Par conséquent, nous pouvons le nommer comme un potentiel de réduction standard. La dénotation pour ce terme est SRP. Nous pouvons l'écrire sous la forme d'une demi-réaction de réduction. La formule générale et le cuivre comme exemple sont donnés ci-dessous:

Demi-réaction de la réduction du cuivre: Cu2+ + 2E- ⟶ Cu(S)
La valeur du potentiel de réduction standard pour la réaction ci-dessus (réduction du cuivre) est 0.34 V, qui est la valeur exacte, mais le signe opposé de celui du potentiel d'oxydation de la même espèce chimique, cuivre. Par conséquent, nous pouvons développer une relation entre les potentiels d'oxydation et de réduction standard comme suit:
E00(Srp) = -e00(AMADOUER)
Quelle est la différence entre le potentiel d'oxydation et le potentiel de réduction?
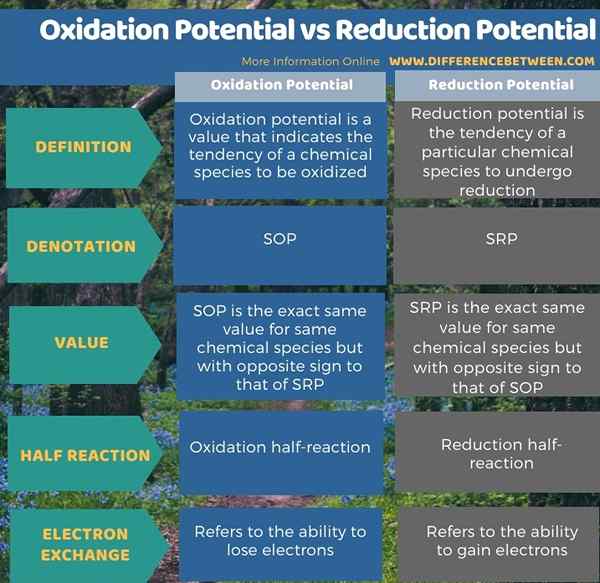
Le potentiel d'oxydation et le potentiel de réduction sont deux types de valeurs de potentiel d'électrode pour les espèces chimiques données en volts dans des conditions standard. La principale différence entre le potentiel d'oxydation et le potentiel de réduction est que le potentiel d'oxydation indique la tendance d'un élément chimique à être oxydé, tandis que le potentiel de réduction indique la tendance d'un élément chimique. Étant donné que ces valeurs potentielles sont mesurées dans des conditions standard, nous devons les nommer comme potentiel d'oxydation standard et potentiel de réduction standard.
De plus, nous les désignons comme SOP et SRP. De plus, il existe une relation entre ces deux termes; Le potentiel d'oxydation standard est exactement la même valeur mais avec un signe différent de celui du potentiel de réduction standard.
L'infographie ci-dessous résume la différence entre le potentiel d'oxydation et le potentiel de réduction.

Résumé - Potentiel d'oxydation vs potentiel de réduction
Le potentiel d'oxydation et le potentiel de réduction sont deux types de valeurs de potentiel d'électrode pour les espèces chimiques données en volts dans des conditions standard. La principale différence entre le potentiel d'oxydation et le potentiel de réduction est que le potentiel d'oxydation indique la tendance d'un élément chimique à être oxydé, tandis que le potentiel de réduction indique la tendance d'un élément chimique.
Référence:
1. «Potentiel de réduction standard». Chemistry LibreTexts, 2019, disponible ici.


