Différence entre l'oxalate et l'acide oxalique
Le différence clé entre l'oxalate et l'acide oxalique est que L'oxalate est un anion tandis que l'acide oxalique est un composé organique.
L'oxalate est la base conjuguée de l'acide oxalique. Cependant, la formation d'acide oxalique est une réaction étapes, qui donne une collection de quelques composés connus sous le nom d'acide oxalique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxalate
3. Qu'est-ce que l'acide oxalique
4. Comparaison côte à côte - oxalate vs acide oxalique sous forme tabulaire
5. Résumé
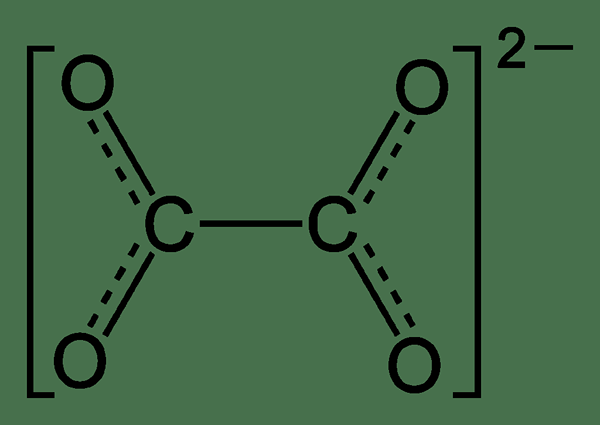
Qu'est-ce que l'oxalate?
L'oxalate est un anion ayant la formule chimique C2O42-. C'est un Dianion car c'est une combinaison de deux espèces chargées que nous pouvons écrire en tant que (COO)22-. Nous pouvons abréger cet ion comme un «bœuf». De plus, il peut se produire sous forme d'anion dans des composés ioniques ou comme un ligand dans les composés de coordination. Cependant, la conversion de l'oxalate en acide oxalique est une réaction compliquée et passante.

Figure 01: Structure de l'oxalate
De plus, la masse molaire de cet ion est de 88 g / mol. Lorsque vous envisagez la structure de cet anion, la géométrie peut être une structure planaire ou décalée selon l'analyse cristallographique des rayons X.
Qu'est-ce que l'acide oxalique?
L'acide oxalique est un composé organique ayant la formule chimique H2C2O4. C'est un solide incolore qui se dissout facilement dans l'eau. C'est un acide dicarboxylique car il s'agit d'une combinaison de deux groupes d'acide carboxylique; En fait, c'est l'acide dicarboxylique le plus simple. De plus, il a une force acide élevée et c'est un agent réducteur fort. La base conjuguée de cet acide est l'ion oxalate.

Figure 02: Structure de l'acide oxalique
En règle générale, cet acide se produit sous la forme de dihydrate. De plus, il se produit naturellement dans certains aliments. La masse molaire de la forme anhydre est de 90 g / mol.
Quelle est la différence entre l'oxalate et l'acide oxalique?
La principale différence entre l'oxalate et l'acide oxalique est que l'oxalate est un anion alors que l'acide oxalique est un composé organique. De plus, la masse molaire d'oxalate est de 88 g / mol tandis que la masse molaire de l'acide oxalique est de 90 g / mol. L'acide conjugué de l'ion oxalate est l'acide oxalique tandis que la base conjuguée de l'acide oxalique est l'oxalate.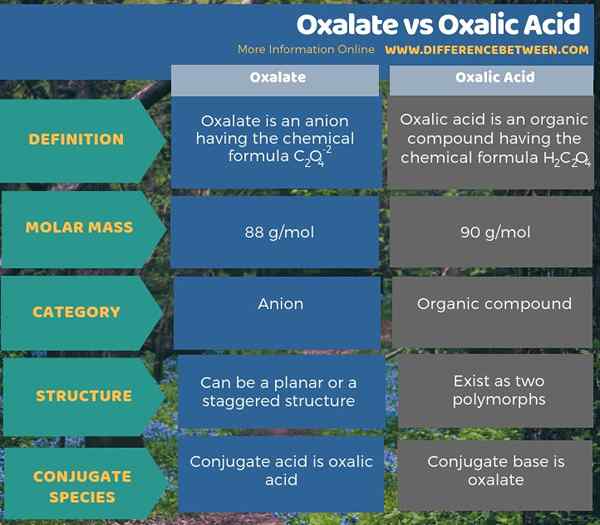
Résumé - Oxalate vs acide oxalique
L'oxalate est l'anion qui provient de l'acide oxalique. L'acide oxalique est un composé organique. La principale différence entre l'oxalate et l'acide oxalique est que l'oxalate est un anion alors que l'acide oxalique est un composé organique.
Référence:
1. "Acide oxalique.»Wikipedia, Wikimedia Foundation, 12 septembre. 2019, disponible ici.
Image gracieuseté:
1. «Oxalate-ion-2d-skeletal» par Kemikungen - propre travail, domaine public) via les communes Wikimedia
2. «Oxalsäure2» par neurotiker - propre travail, domaine public) via Commons Wikimedia


