Différence entre l'ordre de réaction et la molécularité
Différence clé - ordre de réaction vs molécularité
Les réactions chimiques sont des changements qui se produisent dans les composés chimiques. Cela conduit à la conversion d'une substance chimique à un autre. Les composés initiaux qui subissent la réaction chimique sont appelés réactifs. Ce que nous obtenons à la fin de la réaction, ce sont les produits. L'ordre de la réaction est donné en ce qui concerne une substance; il peut être par rapport à un réactif, un produit ou un catalyseur. L'ordre de réaction par rapport à une substance est l'exposant auquel sa concentration dans l'équation de vitesse est augmentée. La molécularité des réactions chimiques exprime la quantité de molécules de réactifs impliqués dans la réaction. La principale différence entre l'ordre de réaction et la molécularité est que L'ordre de réaction donne la relation entre la concentration d'une espèce chimique et la réaction qu'elle subit tandis que la molécularité indique combien de molécules de réactif sont impliquées dans la réaction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ordre de réaction
3. Qu'est-ce que la molécularité
4. Comparaison côte à côte - ordre de réaction vs molécularité sous forme tabulaire
5. Résumé
Qu'est-ce que l'ordre de réaction
L'ordre de réaction par rapport à une substance est l'exposant auquel sa concentration dans l'équation de vitesse est augmentée. Afin de comprendre ce concept, nous devons d'abord savoir ce qu'est la loi sur les taux.
Loi sur les taux
La loi de taux indique que le taux de progression d'une réaction chimique (à température constante) est proportionnel aux concentrations de réactifs élevés aux exposants déterminés expérimentalement. Ces exposants sont appelés ordres de ces concentrations. analysons un exemple.
2n2O5 ↔ 4 Non2 + O2
Pour la réaction ci-dessus, l'équation de la loi de vitesse est donnée comme ci-dessous.
Taux = k.[N2O5]]X
Dans l'équation ci-dessus, k est la constante de proportionnalité connue sous le nom de constante. C'est une constante à température constante. Les supports sont utilisés pour exprimer qu'il s'agit de la concentration du réactif. Le symbole x est l'ordre de la réaction par rapport au réactif. La valeur de x doit être déterminée expérimentalement. Pour cette réaction, il a été constaté que x = 1. Ici, nous pouvons voir que l'ordre de réaction n'est pas égal à la stoechiométrie de la réaction. Mais dans certaines réactions, l'ordre de réaction peut être égal à la stoechiométrie.
Pour une réaction ayant deux ou plusieurs réactifs, le Équation de la loi sur les taux peut être écrit comme ci-dessous.
A + B + C ↔ P
Taux = k.[UN]un[B]b[C]c
A, B et C sont des ordres de réaction par rapport aux réactifs A, B et C, respectivement. Pour ce type d'équations de vitesse (ayant plusieurs ordres de réaction), la somme des ordres de réaction est donnée comme l'ordre global de réaction.
Ordre global = A + B + C

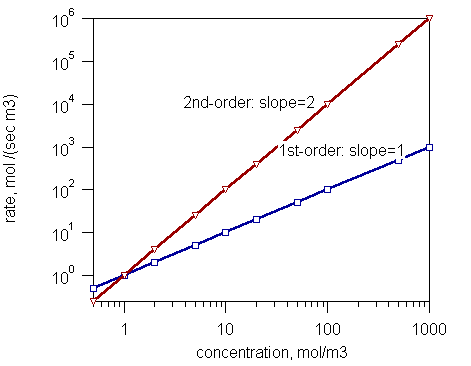
Figure 1: Rate de réactions de premier ordre et de deuxième ordre
Selon l'ordre de réaction, il existe plusieurs types de réactions:
- Réactions d'ordre zéro (L'ordre de réaction est zéro par rapport à tout réactif utilisé. Par conséquent, la vitesse de réaction ne dépend pas des concentrations des réactifs utilisés.)
- Réactions de premier ordre (Le taux est proportionnel à la concentration d'un réactif)
- Réactions de second ordre (La vitesse de réaction est proportionnelle soit au carré de la concentration d'un réactif, soit au produit de concentrations de deux réactifs)
Qu'est-ce que la molécularité
La molécularité d'une réaction est le nombre de molécules ou d'ions qui participent à une réaction en tant que réactifs. Plus important encore, les réactifs considérés sont ceux qui participent à l'étape de détermination du taux de la réaction globale. L'étape de détermination de la vitesse d'une réaction est l'étape la plus lente de la réaction globale. En effet, l'étape de réaction la plus lente détermine la vitesse de réaction.
Figure 2: une réaction unimoléculaire
La molécularité peut être de différents types:
- Les réactions unimoléculaires ont une molécule de réactive (ou ion)
- Les réactions bimoléculaires ont deux réactifs (deux réactifs peuvent être du même composé ou des composés différents)
- Les réactions tricoléculaires ont trois réactifs.
Quelle est la différence entre l'ordre de réaction et la molécularité?
Ordre de réaction vs molécularité | |
| L'ordre de la réaction par rapport à une substance est l'exposant auquel sa concentration dans l'équation de vitesse est augmentée. | La molécularité d'une réaction est le nombre de molécules ou d'ions qui participent à une réaction en tant que réactifs. |
| Relation avec les réactifs | |
| L'ordre de réaction explique comment la concentration des réactifs affecte la vitesse de réaction. | La molécularité donne le nombre de réactifs qui participent à une réaction. |
Résumé - Ordre de réaction vs molécularité
La loi sur la vitesse indique que le taux de progression d'une réaction chimique (à température constante) est proportionnel aux concentrations de réactifs élevés aux exposants déterminés expérimentalement. Un ordre de réaction est donné en ce qui concerne un réactif. Il explique la dépendance de la vitesse de réaction sur les concentrations de réactifs. La principale différence entre l'ordre de réaction et la molécularité est que l'ordre de réaction donne la relation entre la concentration d'une espèce chimique et la réaction qu'elle subit tandis que la molécularité exprime le nombre de molécules de réactif impliqués dans la réaction.
Référence:
1. «La loi sur les taux.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016, disponible ici.
2. «Ordre de réaction.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016, disponible ici.
3. «Molecularité et cinétique.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016, disponible ici.
Image gracieuseté:
1. «Rateloglogplot» de Fabiuccio ~ EnwikiBooks à l'anglais WikiBooks - transféré de EN.WikiBooks aux communes., (Domaine public) via Commons Wikimedia
2. «CIS-Trans-Stilbène» par Pancrat - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


