Différence entre l'hémoglobine normale et l'hémoglobine à cellules
Différence clé - hémoglobine normale vs drépanocytose hémoglobine
L'hémoglobine (HGB) est la molécule de protéine principale qui fournit la forme typique de la forme ronde des globules rouges avec un centre étroit. La molécule d'hémoglobine est composée de quatre molécules de sous-protéine dans lesquelles deux chaînes sont des chaînes alpha globulines, et les deux autres sont des chaînes bêta globulines. Les atomes de fer dans l'hémoglobine et la forme des globules rouges sont importants pour le transport de l'oxygène à travers le sang. Si la forme de l'hémoglobine est détruite, elle ne parvient pas à transporter l'oxygène à travers le sang. L'hémoglobine falciforme est un type de molécule anormale d'hémoglobine qui provoque une anémie appelée drépanocytose anémie. La principale différence entre l'hémoglobine normale et l'hémoglobine de drépanocytose est que L'hémoglobine normale a de l'acide glutamique dans le 6e position de la séquence d'acides aminés de la chaîne bêta globuline alors que L'hémoglobine falciforme a de la valine dans le 6e position de la chaîne bêta globuline. L'hémoglobine normale et l'hémoglobine à cellules falles ne diffèrent que par un seul acide aminé dans les chaînes bêta.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hémoglobine normale
3. Qu'est-ce que l'hémoglobine à cellules falles
4. Comparaison côte à côte - hémoglobine normale vs hémoglobine à cellules
5. Résumé
Qu'est-ce que l'hémoglobine normale?
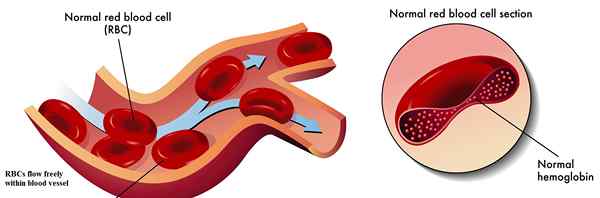
L'hémoglobine est une métalloprotéine contenant du fer trouvée dans les globules rouges. Il est responsable du transport de l'oxygène du poumon aux tissus et organes corporels, et le transport du dioxyde de carbone des tissus corporels au poumon. Il est également connu sous le nom de protéines de transport d'oxygène dans le sang. Il s'agit d'une protéine complexe, qui se compose de quatre petites sous-unités de protéines et de quatre groupes hématiques portant des atomes de fer comme le montre la figure 01. L'hémoglobine a une forte affinité pour l'oxygène. Il existe quatre sites de liaison à l'oxygène situés à l'intérieur d'une molécule d'hémoglobine. Une fois que l'hémoglobine sature d'oxygène, le sang devient de couleur rouge vif et est connu sous le nom de sang oxygéné. Le deuxième état de l'hémoglobine, qui manque d'oxygène, est connu sous le nom de désoxyhémoglobine. Dans cet état, le sang porte la couleur rouge foncé.
Les atomes de fer intégrés dans le composé d'hème de l'hémoglobine facilitent principalement le transport de dioxyde d'oxygène et de carbone. Liaison des molécules d'oxygène à Fe+2 Les ions changent la conformation de la molécule d'hémoglobine. Les atomes de fer dans l'hémoglobine aident également à maintenir la forme typique des globules rouges. Par conséquent, le fer est un élément vital trouvé dans les globules rouges.

Figure 01: hémoglobine normale
Qu'est-ce que l'hémoglobine à cellules falles?
L'anémie falciforme est une condition sanguine causée en raison de protéines anormales d'hémoglobine présente dans les globules rouges. L'hémoglobine falciforme est un type d'hémoglobine anormale trouvée dans les globules rouges. Ils sont également connus sous le nom d'hémoglobine S. Ils possèdent des formes de faucille ou de croissant. Ils sont produits à la suite de la mutation du gène de la drépanocytose. Cette mutation modifie un seul acide aminé dans la séquence d'acides aminés de peptide de chaîne bêta d'hémoglobine normale. L'hémoglobine de drépanocytose est également composée de deux sous-unités alpha et bêta, tout comme l'hémoglobine normale. Cependant, il y a une seule différence d'acide aminé dans les sous-unités bêta en raison de la mutation. Dans l'hémoglobine normale, 6e La position de la chaîne d'acides aminés dans les chaînes bêta est composée d'acide glutamique. Cependant, dans l'hémoglobine de drépanocytose, 6e La position est reprise par un autre acide aminé appelé valine. Bien qu'il s'agisse d'une seule différence d'acide aminé, c'est la cause de l'anémie mettant en danger la vie appelée drépanocytose.
Lorsque Valine est positionnée à 6e, Il fait former la chaîne bêta une saillie qui correspond aux chaînes bêta d'autres molécules d'hémoglobine. Ces connexions font de l'hémoglobine drépanocytaire pour s'agréger sans rester dans la solution et transporter l'oxygène. Il faut une structure rigide, et enfin, les globules rouges se décomposent prématurément, ce qui conduit à des conditions d'anémie.
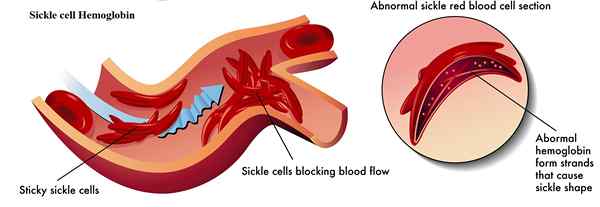
Figure 02: Hémoglobine à cellules falles
Quelle est la différence entre l'hémoglobine normale et l'hémoglobine à cellules falles?
Hémoglobine normale vs drépanocytose hémoglobine | |
| L'hémoglobine normale est une protéine contenant du fer dans les globules rouges, qui transportent l'oxygène et le dioxyde de carbone à travers le sang. | L'hémoglobine falciforme est un type d'hémoglobine anormale qui provoque l'agglutination de la drépanocyte des globules rouges dans le sang. |
| Abréviation | |
| L'abréviation de l'hémoglobine normale est HBA. | L'abréviation de l'hémoglobine de drépanocytose est Hbs. |
| Structure | |
| La structure de l'hémoglobine normale est composée de deux chaînes alpha et de deux chaînes bêta. | La structure de l'hémoglobine de drépanocytose est composée de deux chaînes alpha et de deux chaînes S. |
| Forme | |
| L'hémoglobine normale est ronde avec un centre étroit. | La forme des globules rouges contenant l'hémoglobine de drépanocytose est en forme de croissant ou de faucille. |
| 6e position d'acide aminé | |
| La sixième position dans la chaîne d'acides aminés de la chaîne bêta globuline est l'acide glutamique. | La sixième position est occupée par Valine dans les hémoglobines de drépanocytose. |
| Résultat | |
| L'hémoglobine normale provoque l'écoulement librement des globules rouges dans les vaisseaux sanguins. | L'hémoglobine de drépanocytose provoque le blocage du flux de globules rouges dans les vaisseaux. |
Résumé - Hémoglobine normale vs drépanocytose hémoglobine
L'hémoglobine est la protéine de transport en oxygène dans les globules rouges. Il est composé de quatre sous-unités de protéines nommées Alpha et Beta Chains. Il s'agit d'une molécule contenant du fer qui provoque la couleur et la forme ronde des globules rouges. En raison de mutations, la forme des globules rouges peut différer. Cela se produit en raison de molécules d'hémoglobine anormales dans les globules rouges. L'hémoglobine drépanocytaire est une de ces mutations. Ils changent la forme des globules rouges de la forme ronde à la faucille, ce qui entraîne finalement les destructions prématurées des globules rouges. Cette condition de maladie est connue sous le nom d'anémie falciforme. Cependant, la différence entre l'hémoglobine normale et l'hémoglobine de drépanocénér.
Référence:
1. La biologie moléculaire de l'anémie falciforme. N.p., n.d. la toile. 28 mai 2017. .
2. «Maladie de la drépanocytose - Référence de la maison génétique."U.S. Bibliothèque nationale de médecine. National Institutes of Health, n.d. la toile. 28 mai 2017.
Image gracieuseté:
1. «Facteurs à risque pour-clinter-cellule-anémie (1) 2” par Diana Grib - propre travail (CC BY-SA 4.0) via les communes Wikimedia [Cropped]


