Différence entre nitronium nitrosonium et nitrosyl
Le différence clé entre le nitronium nitrosonium et le nitrosyl est que L'ion nitronium a un atome d'azote lié à deux atomes d'oxygène et l'ion nitrosonium a un atome d'azote lié à un atome d'oxygène tandis que le terme nitrosyle est utilisé lors de la nomment du ligand d'oxyde nitrique dans les complexes métalliques.
Les ions nitronium et nitrosonium sont des ions inorganiques contenant des atomes d'azote et d'oxygène. Ces deux ions se produisent dans des composés chimiques sous forme de cations.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Nitronium
3. Qu'est-ce que le nitrosonium
4. Qu'est-ce que le nitrosyl
5. Quelles sont les similitudes entre le nitrosonium nitronium et le nitrosyl
6. Comparaison côte à côte - Nitronium vs nitrosonium vs nitrosyl sous forme tabulaire
7. Résumé
Qu'est-ce que Nitronium?
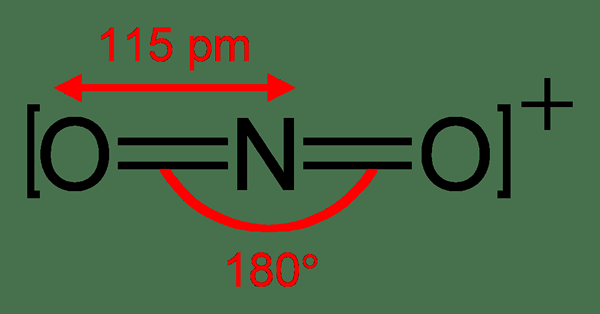
L'ion nitronium est un cation ayant la formule chimique NO2+. Nous pouvons le nommer comme un ion onium en raison de son atome d'azote tétravalent et de la charge électrique +1 qui est similaire à l'ion ammonium. Ce cation est créé lorsqu'un électron élimine la molécule de dioxyde d'azote paramagnétique ou par la protonation de l'acide nitrique.

Figure 01: Structure chimique de l'ion nitronium
Habituellement, l'ion nitronium est suffisamment stable pour exister dans des conditions normales. Cependant, cet ion est généralement réactif et utile en tant qu'électrophile pour la nitration d'autres substances. À cette fin, cet ion est généré in situ en mélangeant l'acide sulfurique concentré et l'acide nitrique concentré.
Nous pouvons observer que l'ion nitronium est isoélectronique avec du dioxyde de carbone et de l'oxyde nitreux, et ils ont la même structure linéaire et l'angle de liaison de 180 degrés. Par conséquent, cet ion a un spectre vibrationnel similaire au dioxyde de carbone.
Il y a peu de sels d'ion nitronium où les anions sont faiblement nucléophiles. Les exemples incluent le perchlorate de nitronium (non2+CLO4-), nitronium tétrafluoroborate (non2+Petit ami4-), nitronium hexafluorophosphate (non2+PF6-), nitronium hexafluoroarsenate (non2+ASF6-), et l'hexafluoroantimonate nitronium (non2+SBF6-).
Qu'est-ce que le nitrosonium?
Le nitrosonium est un cation ayant la formule chimique no+. Ce cation a l'atome d'azote lié à un atome d'oxygène par une triple liaison. Par conséquent, l'ordre de liaison de cette molécule est 3. Cependant, un atome d'oxygène ne peut avoir que deux liaisons chimiques en fonction de sa configuration d'électrons; Ainsi, l'autre liaison chimique est une liaison coordonnée. Par conséquent, les espèces diatomiques globales portent une charge positive nette. Cela apparaît sous forme d'oxyde nitrique avec un électron retiré.
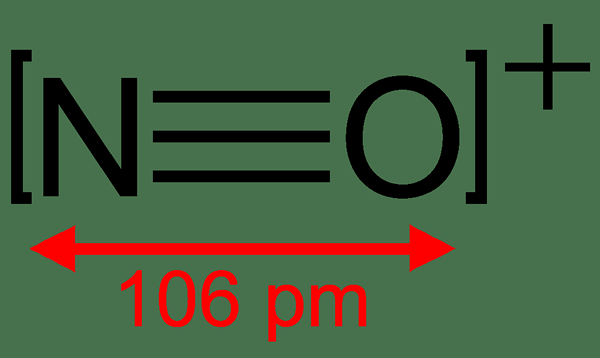
Figure 02: Structure chimique de l'ion nitrosonium
Ce cation est isoélectronique avec du monoxyde de carbone (CO), de l'anion cyanure (CN-) et de la molécule d'azote (N2). Nous pouvons facilement obtenir l'ion de nitrosonium par la protonation de l'acide nitreux. Il réagit facilement avec l'eau, formant l'acide nitreux. Par conséquent, nous devons protéger cet ion contre l'eau ou l'air humide. Lorsque cet ion réagit avec une base, il donne des composés de nitrile. De plus, l'ion de nitrosonium peut réagir avec les aryl amines en tant qu'agent diazotisant. L'ion nitrosonium peut également agir comme un fort agent oxydant.
Qu'est-ce que le nitrosyl?
Le terme nitrosyl est utilisé pour nommer le ligand d'oxyde nitrique dans des complexes métalliques. Le ligand d'oxyde nitrique est lié à un métal de transition central par une liaison de coordination. Les complexes métalliques contenant le ligand NO (oxyde nitrique) n'ont en fait pas de cation + qui est nommé cation nitrosyle (le cation dérivé du ligand nitrosyle).
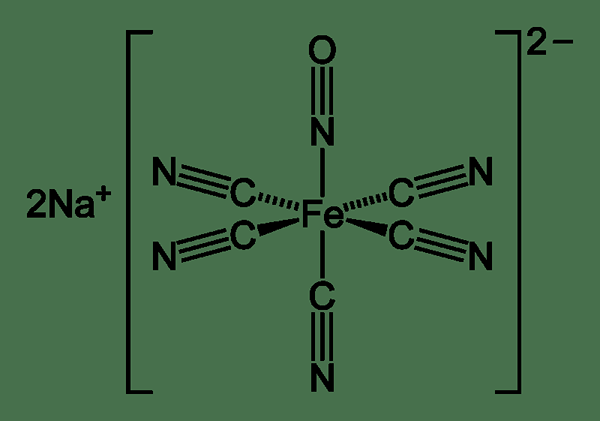
Figure 03: Un complexe de métal de transition contenant du monoxyde de carbone et des ligands nitrosyles
Ce cation est isoélectronique avec du monoxyde de carbone. Par conséquent, le modèle de liaison du monoxyde de carbone avec le métal de transition dans les complexes carbonyle est similaire à celui des complexes nitrosyle.
Quelles sont les similitudes entre le nitrosonium nitronium et le nitrosyl?
- Tous ces ions contiennent des atomes d'azote et d'oxygène.
- Ce sont des cations ayant une charge positive nette.
- Ce sont des oxydes d'azote.
Quelle est la différence entre le nitrosonium nitronium et le nitrosyl?
Le nitronium et le nitrosonium sont des ions oxyde d'azote. La principale différence entre le nitrosonium et le nitrosyle nitronium est que l'ion nitronium a un atome d'azote lié à deux atomes d'oxygène et que l'ion nitrosonium a un atome d'azote lié à un atome d'oxygène tandis que le terme nitrosyle est utilisé lors de la nom.
Vous trouverez ci-dessous un résumé de la différence entre le nitronium nitrosonium et le nitrosyl sous forme tabulaire.

Résumé - Nitronium vs nitrosonium vs nitrosyl
La principale différence entre le nitrosonium et le nitrosyle nitronium est que l'ion nitronium a un atome d'azote lié à deux atomes d'oxygène et que l'ion nitrosonium a un atome d'azote lié à un atome d'oxygène tandis que le terme nitrosyle est utilisé lors de la nom.
Référence:
1. «Nitronium ion». LibreTexts. (2020, 24 août). Disponible ici.
Image gracieuseté:
1. «Nitronium-2d-dimensions» (domaine public) via Commons Wikimedia
2. «Nitrosonium-2d-dimensions» (domaine public) via Commons Wikimedia
3. «Sodium-nitroprusside-2d» (domaine public) via Commons Wikimedia


