Différence entre N2O4 et No2
Le différence clé entre N2O4 et No2 est que N2O4 est diamagnétique, tandis que NO2 est paramagnétique.
N2O4 est le tétroxyde de dinitrogen tandis que le NO2 est un dioxyde d'azote. Bien que la formule chimique N2O4 puisse être obtenue en doublant les valeurs stoechiométriques de la formule chimique NO2, ces deux sont des composés chimiques différents avec des propriétés chimiques et physiques différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que N2O4
3. Qu'est-ce que No2
4. Comparaison côte à côte - N2O4 vs NO2 sous forme tabulaire
5. Résumé
Qu'est-ce que N2O4?
N2O4 est le tétroxyde de dinitrogen. Nous l'appelons généralement comme tétroxyde d'azote. Ce composé se produit comme un liquide incolore et est un réactif très utile dans les processus de synthèse chimique. Ce composé peut former un mélange d'équilibre avec du dioxyde d'azote. De plus, le tétroxyde de dinitrogen est un puissant agent oxydant qui est également hypergolique. Il est hypergolique en contact avec diverses formes d'hydrazine (cela fait du mélange d'hydrazine et de tétroxyde de dinitrogen un bipropellant commun pour les fusées).
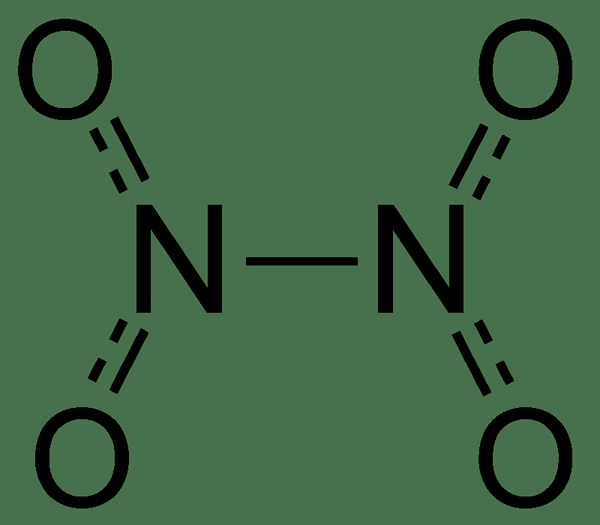
Figure 01: accumulation moléculaire de la molécule de tétroxyde de dinitrogen
Nous pouvons considérer la molécule de tétroxyde de dinitrogen comme deux groupes nitro qui sont liés ensemble. Et, cette réaction particulière forme un mélange d'équilibre de tétroxyde de dinitrogen et de dioxyde d'azote. De plus, nous pouvons observer la molécule de tétroxyde de dinitrogen comme une molécule plane ayant une liaison faible entre deux atomes d'azote. C'est parce que cette liaison chimique est significativement plus longue que la liaison chimique N-N habituelle.
Lorsque l'on considère les propriétés magnétiques de cette molécule, elle est diamagnétique car il n'y a pas d'électrons non appariés sur aucun atome de cette molécule. De plus, cette substance liquide est généralement incolore, mais il peut également y avoir une coloration jaune en raison de la présence de NO2 en fonction de l'équilibre qui a été mentionné ci-dessus. Plus important encore, à des températures élevées, l'équilibre pousse vers NO2 plutôt que N2O4.
Le tétroxyde de dinitrogen peut être produit par l'oxydation catalytique de l'ammoniac, où la vapeur est utilisée comme diluant pour réduire la température de combustion. Dans ce processus de réaction, la première étape comprend l'oxydation de l'ammoniac en oxyde nitrique, et la deuxième étape est l'oxydation de l'oxyde nitrique dans le dioxyde d'azote, suivi d'une dimérisation dans le tétroxyde d'azote.
Qu'est-ce que No2?
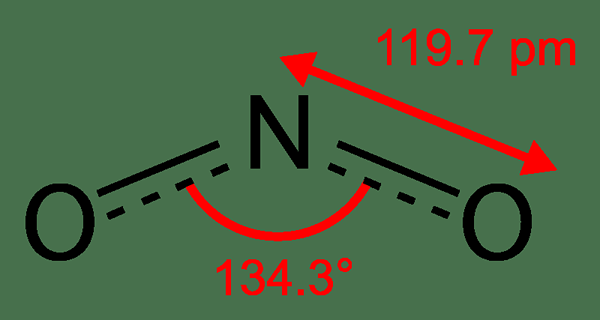
NO2 est le dioxyde d'azote. C'est l'un des nombreux oxydes d'azote. Nous pouvons l'observer comme un intermédiaire dans la synthèse industrielle de l'acide nitrique, ce qui est important dans la production d'engrais. De plus, le NO2 est un gaz brun ayant une odeur de chlore. Lorsqu'il est ajouté à l'eau, ce composé subit une hydrolyse. Cependant, cette substance gazeuse se transforme en un liquide brun jaunâtre à basse température. Et, ce changement de couleur se produit en raison de la conversion de NO2 en N2O4.

Figure 02: Structure chimique du NO2
De manière caractéristique, l'atome d'azote de la molécule NO2 a un électron non apparié tandis qu'il y a deux liaisons N = O dans la molécule. Par conséquent, ce composé est paramagnétique; ce qui signifie qu'il peut être attiré par un champ magnétique externe. De plus, cet seul électron non apparié signifie également qu'il s'agit d'un composé de radicaux libres.
Lorsque vous envisagez la préparation de la substance NO2, elle se forme généralement via l'oxydation de l'oxyde nitrique par l'oxygène dans l'air. De plus, cette substance se forme dans la plupart des processus de combustion utilisant l'air comme agent oxydant.
Il y a peu d'utilisations différentes de NO2, y compris l'utilisation de celui-ci comme intermédiaire dans la fabrication d'acide nitrique, comme agent de nitratation dans la fabrication d'explosifs chimiques, comme inhibiteur de polymérisation des acrylates, comme agent de blanchiment de la farine, etc.
Quelle est la différence entre N2O4 et No2?
N2O4 est le tétroxyde de dinitrogen tandis que le NO2 est un dioxyde d'azote. La principale différence entre N2O4 et NO2 est que N2O4 est diamagnétique, tandis que NO2 est paramagnétique. De plus, N2O4 se produit comme un liquide, tandis que le NO2 est une substance gazeuse. De plus, N2O4 est un liquide incolore tandis que le NO2 est un gaz brun.
L'info-graphique suivant tabule plus de différences entre N2O4 et NO2 pour la comparaison côte à côte.
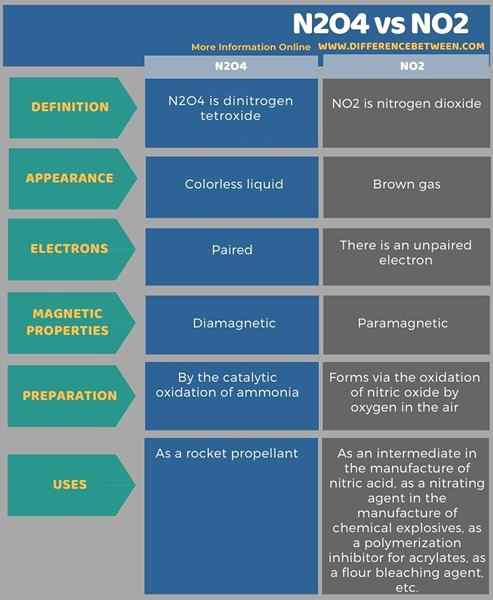
Résumé - N2O4 VS NO2
N2O4 est le tétroxyde de dinitrogen. NO2 est le dioxyde d'azote. Lorsque l'on considère les propriétés chimiques de ces deux composés, les propriétés magnétiques sont très importantes. La principale différence entre N2O4 et NO2 est que N2O4 est diamagnétique, tandis que NO2 est paramagnétique. Diamagnétique signifie que les molécules N2O4 ne sont pas attirées par un champ magnétique externe car il n'y a pas d'électrons non appariés dans cette molécule. Paramagnétique signifie que la molécule est attirée par un champ magnétique externe car il existe un électron non apparié dans la molécule NO2.
Référence:
1. «Tetroxyde de dinitrogen.”PubChem, disponible ici.
Image gracieuseté:
1. «Dinitrogen Tetroxide» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia
2. «Vector-dimensions-dioxyde-2d-dimensions» par Zirguezi - Propre travaux (domaine public) via Commons Wikimedia


