Différence entre les micelles et les particules colloïdales
Le différence clé entre les micelles et les particules colloïdales est que Les micelles se forment à une certaine concentration tandis que les particules colloïdales se forment dès que les solutés sont ajoutés au solvant.
Les termes micelles et particules colloïdales viennent en chimie analytique où les colloïdes sont discutés. Les micelles sont également un type de particules colloïdales.
CONTENU
1. Aperçu et différence clé
2. Que sont les micelles
3. Que sont les particules colloïdales
4. Comparaison côte à côte - Micelles vs particules colloïdales sous forme tabulaire
5. Résumé
Que sont les micelles?
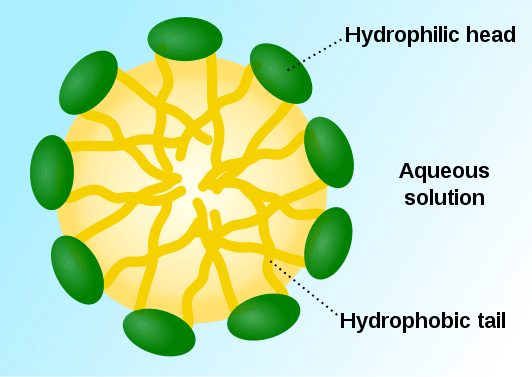
Les micelles sont des particules colloïdales qui se forment sous forme d'agrégats de molécules de surfactant. Ceux-ci sont dispersés dans un milieu liquide et se produit sous forme de colloïdes liquides. Les molécules de tensioactif ont des têtes hydrophiles et des queues hydrophobes. Dans un milieu aqueux, les structures de queue unique hydrophobe ont tendance à repousser les molécules d'eau tandis que les têtes hydrophiles ont tendance à attirer les molécules d'eau. En conséquence, un agrégat se forme de telle manière que les têtes hydrophiles sont en contact avec le solvant, entourant les queues hydrophobes à l'intérieur de la micelle.

Figure 01: Structure d'une micelle typique
Les micelles sont sphériques dans leur forme. De plus, certaines autres formes telles que les ellipsoïdes, les structures cylindriques et les bicouches sont également possibles. La forme de la micelle est déterminée par certains facteurs tels que la géométrie moléculaire de la molécule de surfactant, la concentration de surfactant dans la solution, la température, le pH et la résistance ionique. Le processus de formation des micelles est appelé micellisation.
De plus, les micelles se forment lorsque la concentration du surfactant est supérieure à la concentration critique de micelles de la solution. De plus, la température du système doit être supérieure à la température critique des micelles. Habituellement, les micelles se forment spontanément en raison de l'équilibre entre l'entropie et l'enthalpie du mélange de solvant surfactant.
Que sont les particules colloïdales?
Les particules colloïdales sont les particules qui sont dispersées dans une suspension. Ce type de suspension est appelé suspension colloïdale. Les particules en suspension peuvent être des particules solubles ou insolubles. Un colloïd a deux phases distinctives de la matière: le solvant de phase liquide et les particules de phase solide. La phase liquide est appelée la phase continue, et la phase solide est appelée la phase dispersée, qui est dispersée dans tout le solvant. Habituellement, les particules colloïdales ne se déposent pas ou ne prennent pas beaucoup de temps pour s'installer.

Figure 02: Dans le lait, les particules colloïdales sont des globules de base
Les particules colloïdales sont facilement visibles par un microscope optique. Certains colloïdes sont opaques, mais certains sont translucides. La nature translucide est due à l'effet Tyndall de la diffusion de la lumière. Il existe plusieurs types de colloïdes, selon le type de phase liquide et de phase dispersée. Les suivants sont quelques exemples.
- Si le solvant est liquide et que la phase dispersée est du gaz, nous appelons ce colloïde mousse. Les particules colloïdales sont des agrégats gazeux. E.g. crème fouettée.
- Si le solvant est une phase solide et dispersée est un gaz, alors nous l'appelons mousse solide. Ici aussi, les particules colloïdales sont des agrégats gazeux. E.g. aérogel.
- Si la phase de solvant est du gaz et que la phase dispersée est liquide, nous l'appelons aérosol liquide. Les particules colloïdales sont des agrégats liquides. E.g. Vaporisateurs.
- Si la phase de solvant est liquide et que la phase dispersée est également liquide, nous l'appelons un émulsion. E.g. lait.
- Si la phase de solvant est solide et que la phase dispersée est liquide, nous l'appelons un gel. Les particules colloïdales ici sont des agrégats liquides. E.g. gélose.
- Si la phase de solvant est du gaz et que la phase dispersée est solide, nous l'appelons aérosol solide. E.g. fumée.
- Si la phase de solvant est liquide et que la phase dispersée est solide, nous l'appelons «sol". Les particules colloïdales ici sont des agrégats solides. E.g. sang.
- Si la phase de solvant est solide et que le milieu dispersé est également solide, nous l'appelons sol solide. Les particules colloïdales ici sont des agrégats solides. E.g. vitrage aux canneberges.
Quelle est la différence entre les micelles et les particules colloïdales?
Les micelles sont également un type de particules colloïdales. La principale différence entre les micelles et les particules colloïdales est que les micelles se forment à une certaine concentration tandis que les particules colloïdales se forment dès que les solutés sont ajoutés au solvant. En outre, les micelles se forment en raison des effets hydrophiles et hydrophobes tandis que les particules colloïdales se forment en raison de l'insolubilité ou de la saturation de la solution.
De plus, la taille des micelles peut varier de 2 à 20 nanomètres tandis que la taille des particules colloïdales peut varier de 1 à 1000 nanomètres.
La tabulation ci-dessous montre plus de comparaisons liées à la différence entre les micelles et les particules colloïdales.

Résumé - Micelles vs particules colloïdales
Les termes micelles et particules colloïdales viennent en chimie analytique où les colloïdes sont discutés. Les micelles sont également un type de particules colloïdales. La principale différence entre les micelles et les particules colloïdales est que les micelles se forment à une certaine concentration tandis que les particules colloïdales se forment dès que les solutés sont ajoutés au solvant.
Référence:
1. «Micelle." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2 février. 2018, disponible ici.
Image gracieuseté:
1. «Micelle Scheme-en» par Supermanu - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Verre de lait sur nappe» par I, Chedid (CC BY-SA 3.0) via Commons Wikimedia


