Différence entre Knudsen et diffusion moléculaire
Le différence clé entre Knudsen et la diffusion moléculaire est que La diffusion de Knudsen implique la collision de molécules de gaz avec des parois interstitielles, tandis que la diffusion moléculaire implique le mouvement des molécules d'un système à un autre selon le gradient de concentration.
La diffusion fait référence au mouvement des molécules (spécifiquement des molécules de gaz) à travers un système. Ce processus peut être trouvé dans deux types: diffusion de Knudsen et diffusion moléculaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la diffusion de Knudsen
3. Qu'est-ce que la diffusion moléculaire
4. Comparaison côte à côte - Knudsen vs diffusion moléculaire sous forme tabulaire
5. Résumé
Qu'est-ce que la diffusion de Knudsen?
La diffusion de Knudsen est la diffusion qui se produit lorsque la longueur d'échelle d'un système est comparable ou plus petite que le libre parcours moyen de la particule impliquée. Ce terme est principalement utilisé en physique et en chimie, et il a été nommé d'après le scientifique Martin Knudsen.
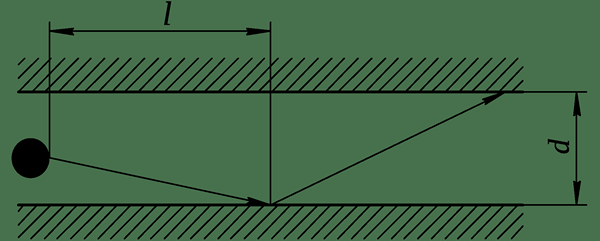
Lorsque l'on considère le mouvement (plus spécifiquement, la diffusion) des molécules de gaz à travers de très minuscules pores capillaires, si le chemin libre moyen des molécules de gaz diffusant est plus grand que le diamètre des pores, cela signifie que la densité de ce gaz est très faible, et Les molécules de gaz ont tendance à entrer en collision avec les parois des pores par rapport aux collisions entre les molécules. Ce processus est nommé la diffusion de Knudsen ou le flux Knudsen.

Figure 01: Une molécule dans un pore de cylindre pendant la diffusion de Knudsen
De plus, nous pouvons définir le nombre de Knudsen, qui est une bonne mesure de la signification relative de la diffusion de Knudsen. Si ce nombre est supérieur à 1, cela signifie que la diffusion de Knudsen est importante pour ce système. Pratiquement, ce nombre ne s'applique qu'aux gaz. En effet.
Qu'est-ce que la diffusion moléculaire?
La diffusion est le mouvement des molécules d'une région de concentration élevée à une faible concentration via un gradient de concentration. Ces mouvements se produisent dans la même solution. Les facteurs qui affectent le gradient de concentration affectent également la diffusion.
Ce mouvement est terminé lorsque les concentrations des deux régions deviennent égales à chaque point. Cela signifie que ce mouvement se produit jusqu'à ce que le gradient de concentration disparaisse. Ensuite, les molécules se propagent partout à l'intérieur de la solution.

Figure 02: Diffusion des ions entre deux systèmes
Le taux de mouvement des molécules par diffusion est fonction de la température, de la viscosité du gaz (ou du liquide) et de la taille des particules. Habituellement, la diffusion moléculaire décrit le flux net de molécules d'une région de concentration élevée à une faible concentration. Lorsque vous envisagez les deux systèmes, A1 et A2, qui sont à la même température et sont capables d'échanger des molécules entre eux, un changement dans l'énergie potentielle dans l'un ou l'autre de ces systèmes peut créer un flux d'énergie d'un système à l'autre (de A1 à A2 ou vice versa) car tout système préfère naturellement les états de faible énergie et d'entropie élevés. Cela crée un état de diffusion moléculaire.
Quelle est la différence entre Knudsen et la diffusion moléculaire?
Il existe deux types de diffusion en tant que diffusion de Knudsen et diffusion moléculaire. La principale différence entre Knudsen et la diffusion moléculaire est que la diffusion de Knudsen implique la collision des molécules de gaz avec des parois interstitielles, tandis que la diffusion moléculaire implique le mouvement des molécules d'un système à l'autre selon le gradient de concentration.
Résumé - Knudsen vs Diffusion moléculaire
Il existe deux types de diffusion en tant que diffusion de Knudsen et diffusion moléculaire. La principale différence entre Knudsen et la diffusion moléculaire est que la diffusion de Knudsen implique la collision des molécules de gaz avec des parois interstitielles, tandis que la diffusion moléculaire implique le mouvement des molécules d'un système à l'autre selon le gradient de concentration.
Référence:
«Diffusion de Knudsen." Un aperçu | Sujets ScienceDirect, Disponible ici.
Image gracieuseté:
1. «Knudsen Diffusion» par Kleveri - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Diffusion self1» par Rosentod - propre travail (domaine public) via Commons Wikimedia


