Différence entre IUPAC et noms communs
Différence clé - IUPAC vs noms communs
La dénomination des composés chimiques est très importante pour s'assurer que les noms chimiques parlés ou écrits ne laissent aucune confusion, et un seul nom ne doit se référer à une seule substance. Les noms de l'IUPAC suivent un ensemble de règles accepté internationalement, Et tous les composés chimiques tirent un nom selon ces règles. En revanche, Les noms communs peuvent être n'importe quel nom qui n'a pas de règles communes. Certains des noms de l'IUPAC sont très difficiles à retenir, et il est très important de mémoriser peu de règles de base pour nommer des composés chimiques. Les gens connaissent davantage les noms chimiques communs que leurs noms IUPAC, car la plupart des Les noms communs sont faciles à retenir, et ils ne contiennent pas de chiffres, de préfixes et de suffixes. C'est le différence clé Entre l'IUPAC et les noms communs.
Quel est le nom IUPAC?
Les noms IUPAC sont la méthode internationalement acceptée de nommer les composés chimiques. En général, il peut être divisé en deux catégories principales; composés inorganiques et composés organiques. Peu importe le nombre de branches et la durée de la structure moléculaire; Les noms IUPAC peuvent être utilisés pour nommer n'importe quelle gamme de molécules. Mais, il est vraiment difficile de nommer avec précision les composés chimiques, sans avoir la bonne connaissance de ces règles.
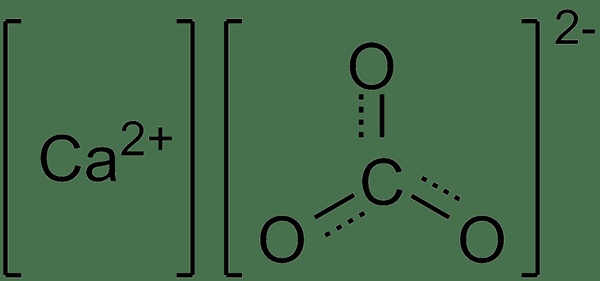
CACO3 - Carbonate de calcium
Quel est le nom commun des composés chimiques?
Les noms communs des composés chimiques ne suivent pas les types spéciaux de règles comme dans les noms IUPAC. En général, les noms communs sont faciles à retenir et commode à utiliser car la méthode de dénomination ne considère pas l'ampleur de la molécule, des groupes fonctionnels ou de la composition moléculaire. Dans certaines occasions, certains produits chimiques ont un seul nom pour leur nom commun et pour le nom IUPAC.

Caco3 - calcaire
Quelle est la différence entre l'IUPAC et les noms communs?
Gamme:
Noms IUPAC: Chaque composé chimique obtient un nom selon la nomenclature IUPAC. Le nom IUPAC est directement lié à sa structure chimique. En d'autres termes, les noms IUPAC considèrent les groupes fonctionnels, les chaînes latérales et d'autres modèles de liaison spéciaux dans la molécule,
Exemples:

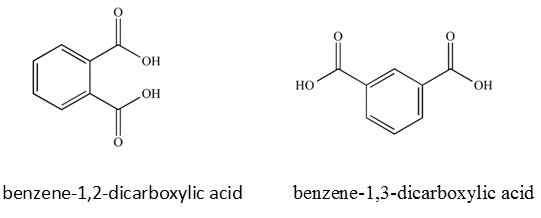
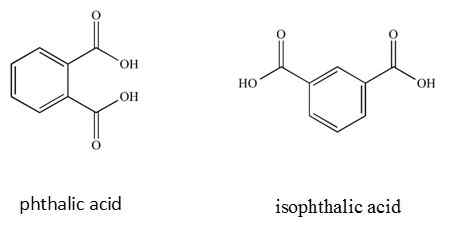
Dans certaines molécules, les noms IUPAC considèrent les positions où les groupes fonctionnels sont situés dans la molécule.
 Noms communs: Certains composés chimiques n'ont pas de noms communs.Certains noms communs sont indépendants de leur structure.
Noms communs: Certains composés chimiques n'ont pas de noms communs.Certains noms communs sont indépendants de leur structure.
Exemples:
- HCOOH - acide formique
- HCHO - Formaldéhyde
- C6H6 - Benzène
- Ch3COOH - acide acétique
Les noms communs ne considèrent pas les positions où les groupes fonctionnels sont attachés.
Exemples:
Composés inorganiques:
| Formule | Nom IUPAC | Nom commun |
| Nahco3bicarbonate de sodium | Hydrogène de sodium | bicarbonate de soude |
| Nabo3 | perborate de sodium | Javel (solide) |
| N / A2B4O7.10 h2O | tétrabate de sodium, de décachydrate | Borax |
| MGSO4.7 h2O | heptahydrate de sulfate de magnésium | Sel d'Epsom |
| Cf2CL2 | dichlorodifluorométhane | Freon |
| PBS | plomb (ii) sulfure | galène |
| Caso4.2 h2O | dihydrate de sulfate de calcium | gypse |
| N / A2S2O3 | thiosulfate de sodium | hypo |
| N2O | oxyde de dinitrogen | gaz hilarant |
| Cao | oxyde de calcium | chaux |
| Caco3 | carbonate de calcium | calcaire |
| Naoh | hydroxyde de sodium | lessive |
| Mg (oh)2 | l'hydroxyde de magnésium | lait de magnésie |
| Sio2 | dioxyde de silicone | quartz |
| NaCl | chlorure de sodium | sel |
Composés organiques:
| Formule | Nom IUPAC | Nom commun |
| Ch3-Ch = ch-ch3 | 2-butène | Symbutane |
| Ch3-Ch (oh) -ch3 | 2-propanol ou propan-2-ol | alcool isopropylique |
| Ch3-Ch2-O-ch2-Ch3 | Éthane éthoxy | L'éther diéthylique |
| Hcooh | Acide méthanoïque | Acide formique |
| Ch3COOH | Acide éthanoique | Acide acétique |
| Ch3-Co-coch2-Ch3 | Éthanoate d'éthyle | Acétate d'éthyle |
| H-co-nh2 | Méthanamide | Foramide |
Image gracieuseté:
1. Carbonate de calcium par Edgar181 (propre travail) [Domaine public], via Wikimedia Commons
2. Un coquillage est largement fait de carbonate de calcium par des images haute résolution d'éléments chimiques [CC par 3.0], via Wikimedia Commons


