Différence entre les isotopes et les isobars et les isotones
Différence clé - Isotopes contre Isobars vs isotones
Les isotopes sont des atomes du même élément chimique ayant un nombre différent de neutrons. Par conséquent, les isotopes du même élément chimique ont le même nombre atomique mais des masses atomiques différentes. Les isobares sont des atomes de différents éléments chimiques. Par conséquent, les nombres atomiques sont essentiellement différents les uns des autres. Les isotones ont le même nombre de neutrons dans leur noyau atomique. Le différence clé entre les isotopes, les isobars et les isotones Les isotopes sont des atomes avec le même nombre de protons, mais un nombre différent de neutrons et d'isobares sont des atomes d'éléments chimiques différents ayant des valeurs égales pour la masse atomique tandis que les isotones sont des atomes d'éléments chimiques différents ayant un nombre égal de neutrons dans le noyau atomique.
CONTENU
1. Aperçu et différence clé
2. Que sont les isotopes
3. Que sont les isobars
4. Que sont les isotones
5. Comparaison côte à côte - isotopes vs isobars vs isotones sous forme tabulaire
6. Résumé
Que sont les isotopes?
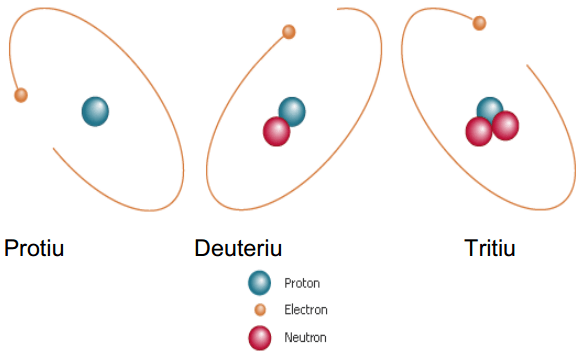
Les isotopes sont des atomes avec le même nombre de protons, mais un nombre différent de neutrons. Un certain nombre de protons dans l'atome sont le nombre atomique de cet atome. Un élément chimique particulier a un nombre fixe de protons. Par conséquent, le nombre atomique des atomes du même élément chimique est similaire les uns aux autres. Par conséquent, les isotopes sont des atomes du même élément chimique. Le nombre total de protons et de neutrons est connu sous le nom de masse atomique. Les isotopes ont des masses atomiques différentes.
Le comportement chimique des isotopes d'un élément chimique est identique, mais les propriétés physiques sont différentes les unes des autres. Presque tous les éléments chimiques ont des isotopes. Il y a 275 isotopes connus de 81 éléments chimiques stables. Pour un élément chimique particulier, il existe des isotopes stables ainsi que des isotopes radioactifs (instable).

Figure 01: Isotopes de l'hydrogène
Un isotope est nommé en utilisant le nom de l'élément chimique et la masse atomique de l'isotope. Par exemple, les deux isotopes de l'hélium sont considérés comme «Helium-2» et «Helium-4». Quelques exemples d'isotopes sont donnés ci-dessous.

Que sont les isobars?
Les isobares sont des atomes d'éléments chimiques différents ayant des valeurs égales pour la masse atomique. La masse atomique est la somme des protons et des neutrons dans le noyau d'un atome. Un proton ou un neutron est connu comme un nucléon. Par conséquent, les isobars ont le même nombre de nucléons.
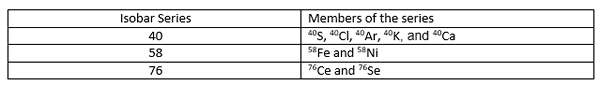
Les nombres atomiques de ces isobars sont différents les uns des autres car différents éléments chimiques ont des nombres atomiques différents. La règle Mattauch Isobar stipule que si deux éléments adjacents sur le tableau périodique ont des isotopes du même numéro de masse (isobars), l'un de ces isotopes doit être radioactif. S'il existe des isobares de trois éléments séquentiels, les premiers et les derniers isobares sont stables, et le milieu peut subir une décroissance radioactive. Une série Isobar est une collection d'isotopes différents qui ont la même masse atomique.
Que sont les isotones?
Les isotones sont des atomes d'éléments différents ayant un nombre égal de neutrons dans le noyau atomique. Les isotones ont des nombres atomiques différents (le nombre de protons dans le noyau est différent les uns des autres) ainsi que des masses atomiques différentes. Il peut être exprimé comme ci-dessous;
Nombre atomique = z
Masse atomique = a
Nombre de neutrons = n
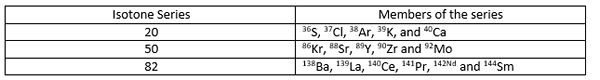
Pour toutes les isotones d'une série, un ≠ z mais (a-z) = n (n est égal pour toutes les isotones d'une série). Quelques exemples pour les isotones sont donnés ci-dessous.
Quelle est la différence entre les isotopes et les isobars et les isotones?
Isotopes vs isobars vs isotones | |
| Isotopes | Les isotopes sont des atomes avec le même nombre de protons, mais un nombre différent de neutrons. |
| Isobars | Les isobares sont des atomes d'éléments chimiques différents ayant des valeurs égales pour la masse atomique. |
| Isotones | Les isotones sont des atomes d'éléments différents ayant un nombre égal de neutrons dans le noyau atomique. |
| Numéro atomique | |
| Isotopes | Les isotopes ont le même numéro atomique. |
| Isobars | Les isobars ont des nombres atomiques différents. |
| Isotones | Les isotones ont des nombres atomiques différents. |
| Masse atomique | |
| Isotopes | Les isotopes ont une masse atomique différente. |
| Isobars | Les isobars ont la même masse atomique. |
| Isotones | Les isotones ont une masse atomique différente. |
| Nombre de neutrons | |
| Isotopes | Les isotopes ont un nombre différent de neutrons. |
| Isobars | Les isobars ont un nombre différent de neutrons. |
| Isotone | Isotones le même nombre de neutrons. |
Résumé - Isotopes vs Isobars vs isotones
Les isotopes, les isobars et les isotones sont des termes utilisés pour décrire les relations entre les atomes de différents éléments chimiques. La différence entre les isotopes, les isobares et les isotones est que les isotopes sont des atomes avec le même nombre de protons, mais un nombre différent de neutrons et d'isobars sont des atomes d'éléments chimiques différents ayant des valeurs égales pour la masse atomique alors que les isotones sont des atomes de différents éléments ayant un nombre égal. de neutrons dans le noyau atomique.
Référence:
1.Helmenstine, Anne Marie, D. «Définition des isotopes et exemples en chimie."Thoughtco, août. 4 2017. Disponible ici
2.Les éditeurs d'Encyclopædia Britannica. «Isotone.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 juillet 1998. Disponible ici
3.«Isobar (nucléde).”Wikipedia, Wikimedia Foundation, 27 décembre. 2017. Disponible ici
4.Herzog, Gregory F. "Isotope.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 décembre. 2017. Disponible ici
Image gracieuseté:
1.'Izotopii HidrogenuUi'By Nicolae Coman - propre travail, (CC By-Sa 3.0) via Commons Wikimedia


