Différence entre l'iodométrie et l'iodimétrie

Le différence clé entre l'iodométrie et l'iodimétrie Nous pouvons utiliser l'iodométrie pour quantifier les agents oxydants, alors que nous pouvons utiliser l'iodimétrie pour quantifier.
L'iodométrie et l'iodimétrie sont deux méthodes de titrage courantes utiles en chimie analytique. La base de ces deux types de titrages est l'oxydation-réduction, et nous pouvons l'utiliser pour déterminer quantitativement les espèces redox. La base du titrage est une réaction entre l'analyte et un réactif standard connu sous le nom de titrant. Nous pouvons déterminer la quantité de l'analyte si nous connaissons la réaction, la stoechiométrie et le volume / masse du titrant nécessaire pour réagir complètement avec l'analyte. De plus, nous pouvons utiliser de l'iode pour ces titrations redox en raison de sa capacité de réagir rapidement avec de nombreuses espèces. Réversibilité de l'iode / iodure, la réaction est également un avantage lors de leur utilisation dans des réactions iodométriques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'iodométrie
3. Qu'est-ce que l'iodimétrie
4. Comparaison côte à côte - iodométrie vs iodimétrie sous forme tabulaire
5. Résumé
Qu'est-ce que l'iodométrie?
Dans l'iodométrie, les iodures réagissent avec un autre agent oxydant dans un milieu acide ou un milieu neutre. Lorsque cette réaction a lieu, l'iodure (nous ajoutons l'iodure sous forme de ki) oxydisse à l'iode et les autres espèces subiront une réduction par l'iodure. Ensuite, nous pouvons titrer l'iode libéré avec une autre espèce. Cette espèce de titrage est une solution standard d'un agent réducteur, qui est capable de réduire l'iode à la forme de l'iodure. Habituellement, nous utilisons une solution de thiosulfate standard pour cela. Par exemple, si nous voulons quantifier la quantité de chlore dissous dans un mélange, ce qui suit est la méthode pour effectuer un titrage iodométrique.
Tout d'abord, nous devons prendre une quantité connue de volume du mélange (dans lequel le chlore est dissous) dans un ballon de titrage. Ensuite, nous pouvons le titrer avec une solution connue de Ki, et nous pouvons trouver le volume consommé.
Après la réaction redox aura lieu dans le ballon de réaction;
CL2 + 2i- -> 2 CL- + je2

Figure 01: Le changement de couleur dans l'iodométrie
Ensuite, nous devons effectuer un autre titrage avec le même mélange pour déterminer la quantité libérée d'iode. Pour cela, nous pouvons titrer le mélange avec une solution de thiosulfate standard. Nous devons ajouter l'amidon comme indicateur, pour déterminer le point final de cette réaction. Avec l'iode et l'amidon dans le mélange, il apparaîtra de couleur bleu foncé, mais au point final lorsque tout l'iode sera terminé, la couleur sombre disparaîtra.
je2 + 2 s2O32− → S4O62− + 2 I-
D'après les deux titrages ci-dessus, nous pouvons déterminer la quantité de Cl2.
Qu'est-ce que l'iodimétrie?
Dans l'iodimétrie, il utilise de l'iode libre pour subir une titration avec un agent réducteur. Par conséquent, l'iode se réduit à l'iodure et l'iode oxydera d'autres espèces.

Figure 02: effectuant un titrage
Comme nous ne pouvons pas facilement préparer une solution d'iode libre, nous devons mélanger l'iode avec l'iodure de potassium et le ki3 Solution pour préparer la solution requise. Et une solution standard de ceci est utilisée pour les titrages iodométriques.
Ki + i2 → Ki3
La réaction suivante a lieu lorsque le titrage. Nous pouvons également utiliser l'amidon comme indicateur pour les titrages iodométriques.
je2 + Agent réducteur → 2 I-
Quelle est la différence entre l'iodométrie et l'iodimétrie?
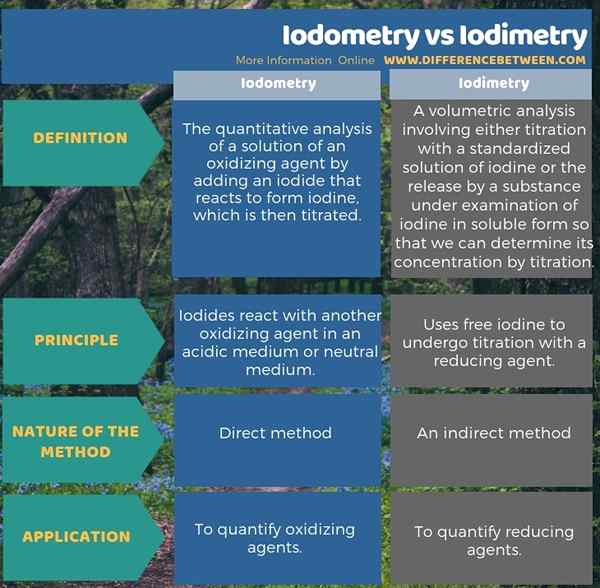
L'iodométrie est l'analyse quantitative d'une solution d'un agent oxydant en ajoutant un iodide qui réagit pour former de l'iode, qui est ensuite titré tandis que l'iodimétrie est une analyse volumétrique impliquant l'une ou l'autre titration avec une solution standardisée d'iode, ou la libération par une substance à l'examen d'iode sous forme soluble, afin que nous puissions déterminer sa concentration par titrage. C'est une différence entre l'iodométrie et l'iodimétrie.
De plus, une autre différence entre l'iodométrie et l'iodimétrie est que, dans l'iodométrie, les iodures réagissent avec un autre agent oxydant dans un milieu acide ou un milieu neutre dans l'iodimétrie, il utilise de l'iode libre pour subir un titrage avec un agent réducteur.
L'infographie ci-dessous présente la différence entre l'iodométrie et l'iodimétrie sous forme tabulaire.
Résumé - Iodométrie vs iodimétrie
Bien que les deux termes l'iodométrie et l'iodimétrie semblent similaires, ce sont deux techniques différentes que nous utilisons en chimie analytique. La principale différence entre l'iodométrie et l'iodimétrie est que nous pouvons utiliser l'iodométrie pour quantifier les agents oxydants, alors que nous pouvons utiliser l'iodimétrie pour quantifier.
Référence:
1. «L'iodométrie.»Wikipedia, Wikimedia Foundation, 9 septembre. 2018. Disponible ici
2. Naviglio, Daniele. "Iodométrie et iodimétrie, Daniele Naviglio" CHIMIE ANALATIQUE "AGRARIA" Federica e-learning.»Federica, Federica Web Learning, Università di Napoli Federico II, 20 mars. 2012. Disponible ici
Image gracieuseté:
1.«Mélange de titrage iodométrique» par Lhchem - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Démonstration de titrage au niveau scolaire» par UCL - Flickr, (CC par 2.0) via Commons Wikimedia


