Différence entre les complexes inertes et labiles
Le différence clé entre les complexes inertes et labiles Les complexes inertes subissent une substitution lente, tandis que les complexes labiles subissent une substitution rapide.
Les termes complexe inerte et complexe labile relèvent de la catégorie des complexes de métaux de transition. Un complexe de métal de transition est un composé inorganique qui a un atome de métal de transition ou un ion au centre du complexe, et il y a deux ou plusieurs ligands attachés à ce centre métallique. Nous pouvons classer ces complexes en deux groupes comme complexes inertes et complexes labiles, en fonction des réactions de substitution qu'ils subissent.
CONTENU
1. Aperçu et différence clé
2. Que sont les complexes inertes
3. Que sont les complexes labiles
4. Comparaison côte à côte - complexes inertes vs labiles sous forme tabulaire
5. Résumé
Que sont les complexes inertes?
Les complexes inertes sont des complexes de métal de transition qui peuvent subir des réactions de substitution très lentement. Parfois, ces complexes ne subissent aucune réaction de substitution. Les complexes inertes sont «inertes» car ils ont une grande énergie d'activation qui peut empêcher les ligands de subir toute réaction de substitution. Par conséquent, les complexes inertes sont des composés cinétiquement stables.

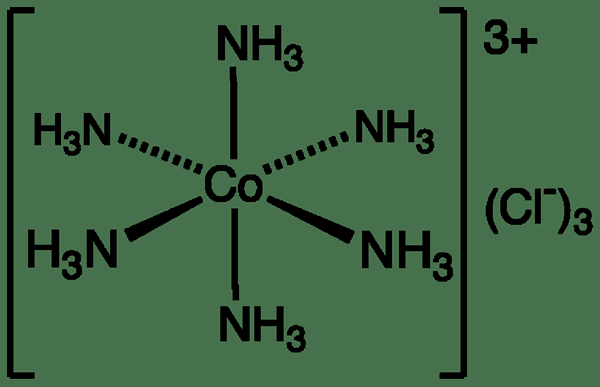
Figure 01: chlorure hexaamminecobalt (iii)
Par exemple, le complexe hexaammonium de cobalt (III) contient un ion cobalt central (+3 ion chargé) attaché à six ligands d'ammonium. Lorsque ce complexe réagit avec les ions hydronium, il peut former un complexe hexaaqua cobalt (iii). La constante d'équilibre pour cette réaction de substitution est d'environ 1064. Cette grande constante d'équilibre indique que le complexe d'ammonium de cobalt est instable que le complexe aqua. Par conséquent, cette réaction de substitution est thermodynamiquement très favorisée, mais la vitesse de la réaction est très faible en raison de la grande barrière d'énergie d'activation. Cela indique que le complexe d'ammonium de l'ion de cobalt est un complexe inerte.
Que sont les complexes labiles?
Les complexes labiles sont des complexes de métal de transition qui peuvent subir rapidement des réactions de substitution. En d'autres termes, les complexes labiles subissent facilement des réactions de substitution lorsqu'il existe un ligand approprié pour la substitution. Ces complexes subissent une substitution rapide car ils ont une barrière d'énergie d'activation très faible. Par conséquent, ces complexes labiles sont des composés cinétiquement instables.
Par exemple, le complexe hexaammonium de cobalt (II) contient un ion cobalt central (avec une charge électrique +2) attachée à six ligands d'ammonium. Lorsque ce complexe réagit avec les ions hydronium, une réaction de substitution se produit. Cette réaction se termine en quelques secondes. En effet.
Quelle est la différence entre les complexes inertes et labiles?
Il existe deux types de complexes de métaux de transition comme complexes inertes et complexes labiles. La principale différence entre les complexes inertes et labiles est que les complexes inertes subissent une substitution lente, tandis que les complexes labiles subissent une substitution rapide. Cela est principalement dû au fait que les complexes inertes sont des complexes thermodynamiquement stables avec une grande barrière d'énergie d'activation. Les complexes labiles, en revanche, sont thermodynamiquement instables, et ils ont une très petite barrière d'énergie d'activation.
Par exemple, le complexe hexaammonium de cobalt (III) est un complexe inerte qui peut subir une réaction de substitution avec des ions hydronium qui prend des semaines. La même réaction se produit en quelques secondes lorsque nous utilisons le complexe hexaammonium de cobalt (II), c'est donc un complexe labile.
L'infographie suivante résume les différences entre les complexes inertes et labiles sous forme tabulaire.
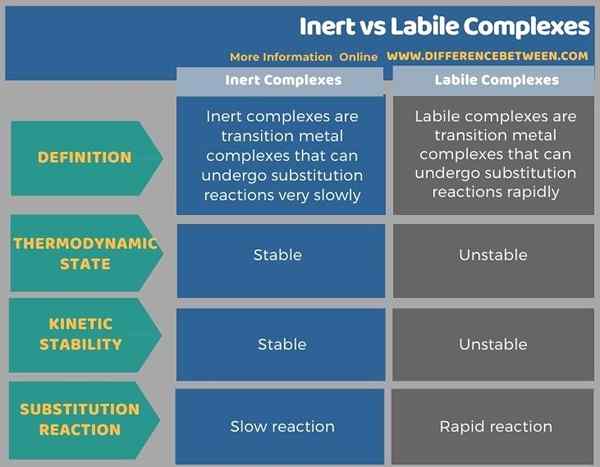
Résumé - complexes inertes vs labiles
Les complexes métalliques de transition sont des composés inorganiques contenant un atome métallique central ou un ion attaché à plusieurs ligands. Ces complexes se trouvent en deux groupes sous forme de complexes inertes et de complexes labiles. La principale différence entre les complexes inertes et labiles est que les complexes inertes subissent une substitution lente, tandis que les complexes labiles subissent une substitution rapide.
Référence:
1. «24.10: Quelques considérations cinétiques." Chemistry LibreTexts, LibreTexts, 14 juillet 2020, disponible ici.
2. Anne Marie Helmenstine. «Qu'est-ce qu'un complexe labile en chimie?”Thoughtco, disponible ici.
Image gracieuseté:
1. «CoA6CL3» par Smokefoot - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia