Différence entre les composés hypervalents et hypovalents
Le différence clé entre les composés hypervalents et hypovalents est que Les composés hypervalents contiennent un atome central avec plus de huit électrons dans la coque d'électrons de valence tandis que les composés hypovalents contiennent un atome central avec moins de huit électrons dans la coque d'électrons de valence.
Les termes hypervalents et hypovalents se réfèrent à des composés covalents inorganiques contenant un atome central. Ces deux types de composés diffèrent les uns des autres en fonction du nombre d'électrons dans l'atome central - les composés hypervalents ont un octet complet tandis que les composés hypovalents n'ont pas.
CONTENU
1. Aperçu et différence clé
2. Quels sont les composés hypervalents
3. Que sont les composés hypovalents
4. Comparaison côte à côte - composés hypervalents vs hypovalents sous forme tabulaire
5. Résumé
Quels sont les composés hypervalents?
Les composés hypervalents sont des espèces chimiques contenant un atome central ayant plus de huit électrons dans la coquille d'électrons de valence. Nous l'appelons également un octet élargi. Le premier scientifique qui a défini ce type de molécules est Jeremy I. Musher, en 1969. Il existe plusieurs classes de composés hypervalents tels que les composés d'iode hypervalents, les composés de gaz nobles comme les composés de xénon, les polyfluorides halogènes, etc.
Figure 01: composés hypervalents
La liaison chimique dans des composés hypervalents peut être décrite sur la base de la théorie orbitale moléculaire. Par exemple, si nous prenons le composé d'hexafluorure de soufre, il a six atomes de fluor liés à un atome de soufre via des liaisons uniques. Par conséquent, il y a 12 électrons autour de l'atome de soufre. Selon la théorie orbitale moléculaire, l'orbite 3S, trois orbitales 3p et six orbitales 2p de chaque atome de fluor contribuent à la formation de ce composé. Par conséquent, il y a un total de dix orbitales atomiques impliquées dans la formation de composés. Selon les configurations d'électrons du soufre et du fluor, il y a de la place pour 12 électrons de valence. Puisqu'il y a 12 électrons, le composé hexafluorure de soufre est un composé hypervalent.
Que sont les composés hypovalents?
Les composés hypovalents sont des espèces chimiques contenant un atome central avec moins de huit électrons dans la coquille d'électrons de valence. Par conséquent, ceux-ci sont nommés en espèces déficientes en électrons. Contrairement aux composés hypervalents, presque tous les composés hypovalents sont des espèces non ioniques. Par conséquent, ce sont principalement des composés alimentés ou granulaires.

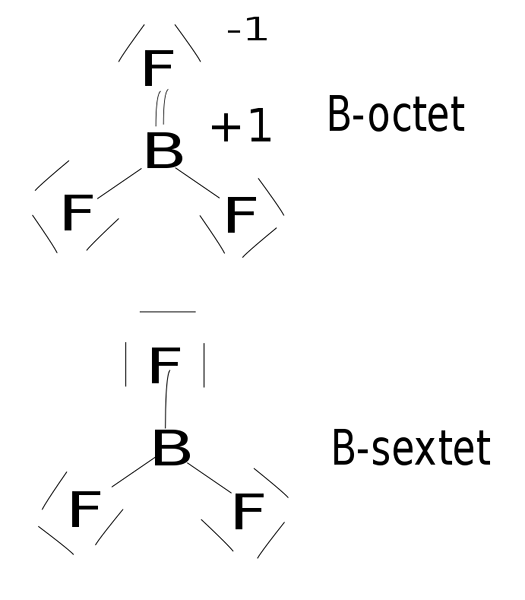
Figure 02: le trifluorure de bore est un composé hypovalent
Ces composés covalents ne portent pas plus de quatre liaisons covalentes uniques autour d'eux, car quatre composés covalents se réfèrent à huit électrons. De plus, les formes des composés covalents sont principalement linéaires ou trigonaux.
Quelle est la différence entre les composés hypervalents et hypovalents?
La principale différence entre les composés hypervalents et hypovalents est que les composés hypervalents sont des espèces chimiques contenant un atome central avec plus de huit électrons dans la coquille d'électrons de valence, tandis que les composés hypovalents sont des espèces chimiques contenant un atome central avec moins de huit électrons dans la coquille d'électrons de valence. De plus, la plupart des composés hypervalents sont des espèces ioniques, tandis que presque tous les composés hypovalents sont des composés covalents.
De plus, les formes des composés hypervalents covalents sont soit des structures tétragonales ou plus complexes, tandis que les composés hypovalents ne peuvent pas former des structures compliquées; Ils sont linéaires ou trigonaux planaires. Ainsi, c'est également une différence significative entre les composés hypervalents et hypovalents. En outre, il y a plus de quatre liaisons covalentes autour de l'atome central des composés hypervalents, mais il y a deux ou trois liaisons covalentes autour de l'atome central des composés hypovalents.

Résumé - Composés hypervalents vs hypovalents
Les termes hypervalents et hypovalents décrivent des composés covalents inorganiques contenant un atome central. La principale différence entre les composés hypervalents et hypovalents est que les composés hypervalents sont des espèces chimiques contenant un atome central avec plus de huit électrons dans la coquille d'électrons de valence, mais les composés hypovalents sont des espèces chimiques contenant un atome central avec moins de huit électrons dans la coquille d'électrons de valence.
Référence:
1. «Molecule hypervalente." Wikipédia, Fondation Wikimedia, 18 janvier. 2020, disponible ici.
Image gracieuseté:
1. «Hypervalency Gamma Calculs» par Marcus Durrant - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «BF3-Lewis» par JCWF à Dutch WikiBooks (CC BY-SA 2.5) Via Commons Wikimedia


