Différence entre l'hydrogénation et la réduction

Le différence clé entre l'hydrogénation et la réduction est que L'hydrogénation nécessite un catalyseur alors que la réduction ne nécessite pas de catalyseur à moins qu'il ne s'agit d'hydrogénation. L'hydrogénation est une forme de réduction de réduction dans laquelle l'hydrogène moléculaire se combine avec une molécule existante. Par conséquent, l'hydrogénation et la réduction se rapportent mutuellement.
Une réduction peut être une diminution du nombre d'oxydation, de la perte d'oxygène ou de l'ajout d'hydrogène. Mais certaines réactions de réduction n'impliquent ni l'oxygène ni l'hydrogène comme réactifs. Par conséquent, la définition la plus acceptable de la réduction est une diminution du nombre d'oxydation. En plus de la différence clé ci-dessus, il existe d'autres différences entre ces deux réactions chimiques telles que les composants de la réaction chimique; Les molécules ayant des liaisons doubles ou triples peuvent subir une hydrogénation tandis que toute molécule ayant des atomes avec un nombre d'oxydation plus élevé peut subir des réactions de réduction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hydrogénation
3. Qu'est-ce que la réduction
4. Comparaison côte à côte - hydrogénation vs réduction de la forme tabulaire
5. Résumé
Qu'est-ce que l'hydrogénation?
L'hydrogénation est une réaction chimique qui inclut l'ajout d'hydrogène moléculaire à une espèce chimique. De plus, cette réaction a généralement lieu en présence d'un catalyseur; nickel, palladium, platine ou leurs oxydes. Il est utile de réduire ou de saturer un composé chimique. L'hydrogénation peut affecter une molécule de deux manières;
- Saturation d'un composé contenant des liaisons doubles ou triples
- Dissociation d'une molécule
Presque tous les composés insaturés sont capables de réagir avec l'hydrogène moléculaire.
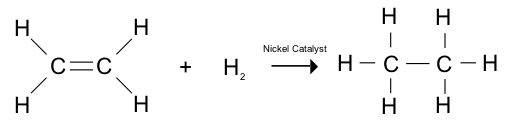
Figure 01: L'hydrogénation des alcènes donne aux alcanes
Cette réaction chimique est utile à de nombreuses fins industrielles pour la synthèse de différents composés tels que l'hydrogénation est utile dans l'industrie du pétrole pour la production de différents pétrochimiques.
Qu'est-ce que la réduction?
La réduction est la diminution du nombre d'oxydation d'une espèce chimique. Cette réaction est une demi-réaction d'une réaction redox (une réaction redox a deux réactions chimiques qui se produisent parallèles les unes aux autres; oxydation et réduction). Une réaction de réduction diminue le nombre d'oxydation tandis que la réaction d'oxydation augmente le nombre d'oxydation.
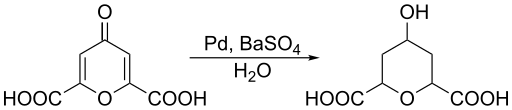
Figure 02: Réduction de l'acide chélidonique
Parfois, la réduction est l'élimination de l'oxygène ou l'ajout d'hydrogène à une espèce chimique. De plus, ce type de réaction se produit de trois manières principales; Diminuez le nombre d'oxydation d'une valeur positive à une valeur négative, de zéro à la valeur négative ou de la valeur négative négative à une valeur négative. Un exemple courant pour une réaction de réduction est la diminution du nombre d'oxydation de cuivre (II) au cuivre (0).
Quelle est la différence entre l'hydrogénation et la réduction?
L'hydrogénation est une réaction chimique qui comprend l'ajout d'hydrogène moléculaire à une espèce chimique. La réduction est la diminution du nombre d'oxydation d'une espèce chimique. Les réactions d'hydrogénation et de réduction sont liées les unes aux autres car l'hydrogénation est une forme de réduction.
Cependant, il existe quelques différences entre ces deux processus chimiques comme indiqué ci-dessous. Par exemple, l'hydrogénation nécessite essentiellement un catalyseur pour la progression de la réaction tandis que la réduction ne nécessite pas de catalyseur à moins qu'il ne s'agit d'hydrogénation. Et aussi, l'hydrogénation se produit avec des molécules insaturées tandis que la réduction se produit avec toute espèce chimique ayant un nombre d'oxydation plus élevé.

Résumé - Hydrogénation vs réduction
L'hydrogénation et la réduction sont des réactions chimiques importantes qui ont de nombreuses applications dans les industries. L'hydrogénation est une forme de réduction. La différence entre l'hydrogénation et la réduction est que l'hydrogénation nécessite un catalyseur alors que la réduction ne nécessite pas de catalyseur à moins qu'il ne s'agit d'hydrogénation.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition de réduction de la chimie.”Thoughtco, sept. 3, 2017. Disponible ici
2. «Hydrogénation.»Wikipedia, Wikimedia Foundation, 25 mai 2018. Disponible ici
Image gracieuseté:
1.«Alcène à Alcane» Robert à Anglais WikiBooks (domaine public) via Commons Wikimedia
2.«Réduction de l'acide Chelidonique» par HBF878 - Propre travaux, (CC0) via Commons Wikimedia


