Différence entre l'acide hydrofluorique et l'acide chlorhydrique

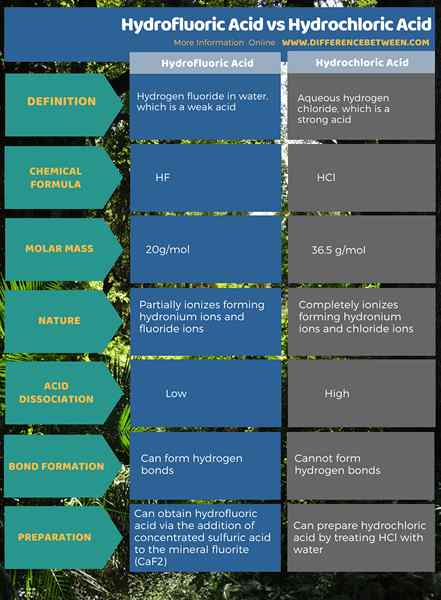
Le différence clé entre l'acide hydrofluorique et l'acide chlorhydrique L'acide hydrofluorique est un acide faible tandis que l'acide chlorhydrique est un acide fort. De plus, l'acide hydrofluorique est capable de former des liaisons hydrogène tandis que l'acide chlorhydrique est incapable de former des liaisons hydrogène.
De plus, une autre différence importante entre l'acide hydrofluorique et l'acide chlorhydrique est dans leur structure moléculaire. Le La molécule d'acide hydrofluorique a un ion fluorure tandis que la molécule d'acide chlorhydrique a un ion chlorure. De plus, l'acide hydrofluorique et chlorhydrique est des donneurs de protons. Par conséquent, ces molécules acides peuvent ioniser dans des médiums aqueux libérant des protons (H+). Ces protons provoquent l'acidité dans le milieu aqueux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide hydrofluorique
3. Qu'est-ce que l'acide chlorhydrique
4. Comparaison côte à côte - acide hydrofluorique vs acide chlorhydrique sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide hydrofluorique?
L'acide hydrofluorique est un fluorure d'hydrogène dans l'eau. Le fluorure d'hydrogène est un composé acide ayant la formule chimique HF et la masse molaire 20 g / mol. De plus, cet acide est un composé de départ pour presque tous les composés contenant du fluor. Ex: Téflon. Cet acide est très réactif avec du verre et modérément réactif avec les métaux. Par conséquent, il est stocké dans des contenants en plastique. Cependant, un récipient en téflon est légèrement perméable à cet acide.

Figure 01: Une bouteille d'acide hydrofluorique
L'acide hydrofluorique est un acide faible. C'est parce qu'il a une constante de dissociation plus faible. La dissociation de cet acide donne des ions hydronium (combinaison de protons et de molécules d'eau forment des ions hydronium) et des ions fluorures. Parmi les acides hydrohaliques, c'est le seul acide faible. Nous pouvons obtenir cet acide via l'ajout d'acide sulfurique concentré à la fluorite minérale (CAF2).
Qu'est-ce que l'acide chlorhydrique?
L'acide chlorhydrique est un chlorure d'hydrogène aqueux. Le chlorure d'hydrogène a la formule chimique HCl, et sa masse molaire est 36.5 g / mol. Cet acide a une odeur piquante. De plus, il est important en tant que composé de départ pour de nombreux produits chimiques inorganiques tels que le chlorure de vinyle.

Figure 02: Une bouteille d'acide chlorhydrique
Contrairement à HF, le HCL est un acide fort qui peut complètement ioniser dans le milieu aqueux, formant des ions hydronium et des ions chlorure. Ainsi, cet acide a une valeur KA élevée. Nous pouvons préparer cet acide en traitant du HCl avec de l'eau.
Quelle est la différence entre l'acide hydrofluorique et l'acide chlorhydrique?
L'acide hydrofluorique est un fluorure d'hydrogène dans l'eau. C'est un acide faible et il peut former des liaisons hydrogène. L'acide chlorhydrique est un chlorure d'hydrogène aqueux. C'est un acide fort, et il ne peut pas former des liaisons hydrogène. C'est la principale différence entre l'acide hydrofluorique et l'acide chlorhydrique.
De plus, la molécule d'acide hydrofluorique a un ion fluorure tandis que la molécule d'acide chlorhydrique a un ion chlorure. Cependant, ce sont des acides hydrohaliques qui ont un atome d'hydrogène lié à un halogène. De plus, l'acide hydrofluorique est le seul acide faible parmi les autres acides hydrohaliques.
Résumé - Acide hydrofluorique vs acide chlorhydrique
L'acide hydrofluorique et chlorhydrique sont des acides hydrohaliques car ces deux composés acides ont un halogénure lié à un atome d'hydrogène. De plus, il existe de nombreuses différences entre ces deux acides. La différence entre l'acide hydrofluorique et l'acide chlorhydrique est que l'acide hydrofluorique est un acide faible et qu'il peut former des liaisons hydrogène tandis que l'acide chlorhydrique est un acide fort et il n'est pas capable de former des liaisons hydrogène.
Référence:
1. "Acide hydrofluorique.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. "Acide hydrochlorique.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.«Fluorure hydrogène 'par utilisateur: Dorgan - autochotographié, (CC by-sa 3.0) via Commons Wikimedia
2.«Acide chlorhydrique 05» (domaine public) via Commons Wikimedia


