Différence entre les orbitales hybrides et dégénérés
Le différence clé entre les orbitales hybrides et dégénérés Les orbitales hybrides sont de nouvelles orbitales qui se forment à partir du mélange de deux orbitales ou plus, tandis que les orbitales dégénérées existent à l'origine dans un atome.
Comme son nom l'indique, une orbite hybride est un hybride de deux orbitales ou plus. Bien que le nom dégénéré orbital semble le même, ils ne sont pas des orbitales nouvellement formées - ils existent déjà dans un atome. De plus, toutes les orbitales hybrides d'une molécule ont la même énergie tandis que les orbitales dégénérées dans un atome ont la même énergie.
CONTENU
1. Aperçu et différence clé
2. Que sont les orbitales hybrides
3. Que sont les orbitales dégénérées
4. Comparaison côte à côte - Hybride vs orbitales dégénérées sous forme tabulaire
5. Résumé
Que sont les orbitales hybrides?
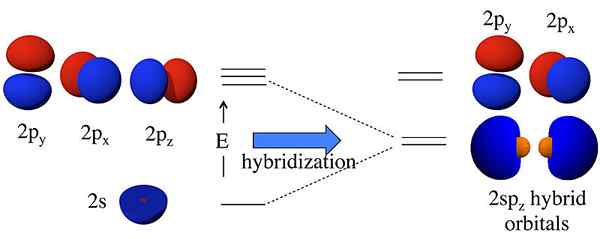
Les orbitales hybrides sont des orbitales formées par la combinaison de deux orbitales atomiques ou plus. Nous appelons cette hybridation de processus combinée. Avant la formation de ces orbitales, les orbitales atomiques peuvent avoir des énergies différentes, mais après la formation, toutes les orbitales ont la même énergie. Par exemple, une orbitale atomique S et une orbitale atomique P peuvent se combiner pour former deux orbitales SP. Les orbitales atomiques S et P ont des énergies différentes (énergie de S < energy of p). But, hybridization results in the formation of two sp orbitals having the same energy; this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Figure 01: Hybridation SP
L'idée de l'hybridation est d'abord entrée dans la discussion parce que les scientifiques ont observé que la théorie des liaisons de valence ne prédisse pas correctement la structure de certaines molécules telles que CH4. Bien que l'atome de carbone n'ait que deux électrons non appariés selon sa configuration d'électrons, il peut former quatre liaisons covalentes. Afin de former quatre obligations, il doit y avoir quatre électrons non appariés. La seule façon d'expliquer ce phénomène était de penser que les orbitales S et P de l'atome de carbone fusionnent les unes avec les autres pour former de nouvelles orbitales appelées orbitales hybrides, qui ont la même énergie. Ici, un s + trois p donne 4 sp3 orbitales. Par conséquent, les électrons remplissent uniformément ces orbitales hybrides (un électron par orbite hybride), obéissant à la règle du Hund. Ensuite, il y a quatre électrons pour la formation de quatre liaisons covalentes avec quatre atomes d'hydrogène.
Que sont les orbitales dégénérées?
Les orbitales dénigrés sont les orbitales atomiques ayant la même énergie. Par exemple, dans la sous-coquille orbitale, il existe trois orbitales atomiques qui diffèrent les unes des autres en fonction de la disposition spatiale. Bien que l'énergie de ces trois orbitales P soit la même, elles sont disposées différemment; Par conséquent, nous les appelons des orbitales dégénérées.
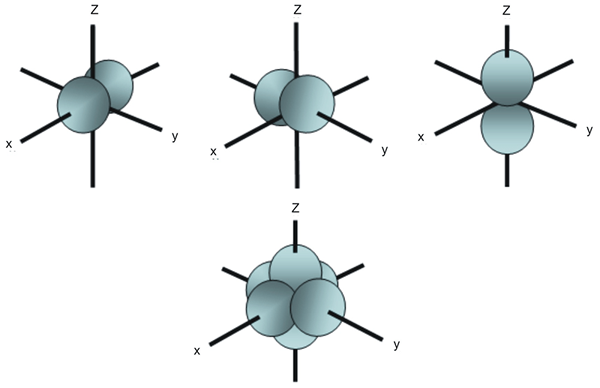
Figure 02: Arrangement spatial de trois orbitales p
Cependant, en présence d'un champ magnétique externe, nous pouvons éliminer la dégénérescence. C'est parce que les orbitales dégénérées ont tendance à obtenir des énergies différentes en présence de ce champ magnétique externe, et ils ne sont plus des orbitales dégénérées. De plus, cinq orbitales d dans la sous-coquille D sont également des orbitales dégénérées car elles ont la même énergie.
Quelle est la différence entre les orbitales hybrides et dégénérés?
La principale différence entre les orbitales hybrides et dégénérées est que les orbitales hybrides sont de nouvelles orbitales formées par le mélange de deux orbitales ou plus, tandis que les orbitales dégénérées sont des orbitales qui existent à l'origine dans un atome. De plus, les orbitales hybrides sont des orbitales moléculaires, tandis que les orbitales dégénérées sont des orbitales atomiques. De plus, les orbitales hybrides sont des orbitales moléculaires ayant la même énergie tandis que les orbitales dégénérées sont des orbitales atomiques ayant la même énergie. Par exemple, SP, SP2 et sp3 Les orbitales sont des orbitales hybrides tandis que trois orbitales p dans le sous-coquille p.

Résumé - Hybride vs orbitales dégénérées
Les orbitales hybrides sont des orbitales moléculaires tandis que les orbitales dégénérées sont des orbitales atomiques. La principale différence entre les orbitales hybrides et dégénérées est que les orbitales hybrides se forment par le mélange de deux orbitales ou plus, tandis que les orbitales dégénérées existent à l'origine dans un atome.
Référence:
1. Helmenstine, Anne Marie. «Définition orbitale hybride.”Thoughtco, Jun. 22, 2018, disponible ici.
Image gracieuseté:
1. «Hybridation SP» par TEM5PSU - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «PX PY PZ ORBITALS» par CK-12 Foundation - File: High School Chemistry.PDF, page 268 (CC BY-SA 3.0) via Commons Wikimedia


