Différence entre l'équilibre homogène et hétérogène
Le différence clé entre l'équilibre homogène et hétérogène est que En équilibre homogène, les réactifs et les produits sont dans la même phase de matière alors que, en équilibre hétérogène, les réactifs et les produits sont en différentes phases.
L'équilibre est un état dans lequel les concentrations de réactifs et de produits restent constantes. Il existe deux types d'équilibres comme équilibre homogène et équilibre hétérogène. Ces deux types diffèrent les uns des autres en fonction de la phase de matière des réactifs et des produits dans l'équilibre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équilibre homogène
3. Qu'est-ce que l'équilibre hétérogène
4. Comparaison côte à côte - homogène vs. Équilibre hétérogène sous forme tabulaire
5. Résumé
Qu'est-ce que l'équilibre homogène?
L'équilibre homogène est un état dans lequel les réactifs et les produits sont dans la même phase de matière. Habituellement, les réactifs et les produits sont en une seule solution. Nous appelons ce type de mélange réactionnel comme un mélange homogène. Les espèces chimiques qui sont dans ce mélange peuvent être des molécules, des ions ou une combinaison de molécules et d'ions. De plus, l'expression de la constante d'équilibre de ce type de réaction comprend les concentrations de tous les réactifs et produits. Par exemple, le mélange de gaz de dioxyde de soufre et d'oxygène de gaz donne du gaz de soufre, tous les réactifs et produits sont en phase gazeuse. Ensuite, la réaction et la constante d'équilibre (k) sont les suivantes:
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
K = [donc3 (g)]]2/[DONC2 (g)]2[O2 (g)]]

Qu'est-ce que l'équilibre hétérogène?
L'équilibre hétérogène est un état dans lequel les réactifs et les produits sont en différentes phases. Là, les phases peuvent y avoir n'importe quelle combinaison de phases solides, liquides et gazeuses. Cependant, contrairement aux équilibres homogènes, lors de l'écriture de la constante d'équilibre pour l'équilibre hétérogène, nous devons exclure les concentrations de solides et de liquides purs. Par exemple, le mélange de carbone sous forme solide avec l'oxygène gazeux donne du monoxyde de gaz. Ensuite, la réaction et la constante d'équilibre (k) sont les suivantes:
O2(g) + 2c(S) ⇌ 2CO(g)
K = [co(g)]]2/ [O2 (g)]]
Quelle est la différence entre l'équilibre homogène et hétérogène?
L'équilibre est un état dans lequel les concentrations de réactifs et de produits restent constantes. Il existe deux types d'équilibres comme équilibre homogène et équilibre hétérogène. La principale différence entre l'équilibre homogène et hétérogène est que dans l'équilibre homogène, les réactifs et les produits sont dans la même phase de matière tandis que, en équilibre hétérogène, les réactifs et les produits sont en différentes phases.
De plus, lors de la détermination de la constante d'équilibre pour les équilibres homogènes, nous devons inclure des concentrations de tous les réactifs et produits; Cependant, lors de la détermination des équilibres hétérogènes, nous devons exclure les concentrations de solides et de liquides purs et devons utiliser les concentrations d'autres réactifs et produits. Par exemple, 2So2 (g) + O2 (g) ⇌ 2SO3 (g) est un équilibre homogène et o2 (g) + 2c(S) ⇌ 2CO(g) est un exemple pour un équilibre hétérogène.
Ci-dessous, l'infographie tabule la différence entre l'équilibre homogène et hétérogène.
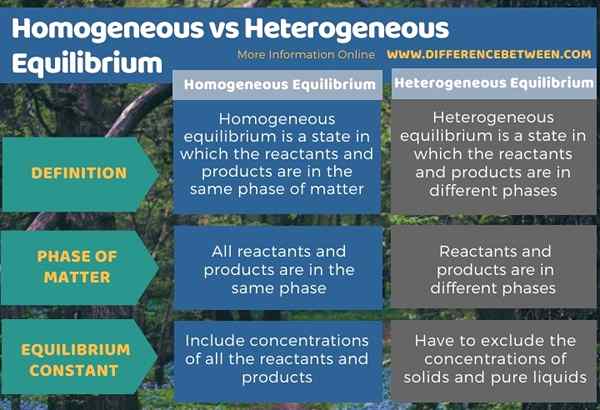
Résumé - Homogène vs. Équilibre hétérogène
L'équilibre est un état dans lequel les concentrations de réactifs et de produits restent constantes. Il existe deux types d'équilibres comme équilibre homogène et équilibre hétérogène. La principale différence entre l'équilibre homogène et hétérogène est que dans l'équilibre homogène, les réactifs et les produits sont dans la même phase de matière tandis que, en équilibre hétérogène, les réactifs et les produits sont en différentes phases. De plus, la constante d'équilibre pour les équilibres homogènes comprend des concentrations de tous les réactifs et produits, tandis que la constante d'équilibre pour les équilibres hétérogènes doit exclure les concentrations de solides et de liquides purs.
Référence:
1."Quelles sont les réactions d'équilibre homogène et hétérogène". Étude.com, étude.com, disponible ici.
2.«15.4: équilibres hétérogènes.”Chemistry LibreTexts, LibreTexts, 18 septembre. 2019, disponible ici.
3. «Équilibres de solution homogène et hétérogène.«Biologie sans limites. Lumen, disponible ici.
Image gracieuseté:
1. «Mélanges et substances pures 2 × 2» par John Trombley - propre travail (CC par 4.0) via Commons Wikimedia


