Différence entre Homo et Lumo
Le différence clé entre homo et lumo est que le Homo fait don d'électrons tandis que le lumo reçoit des électrons.
Les termes Homo et Lumo sont sous la «théorie orbitale moléculaire» subtopique en chimie générale. Le terme homo représente «l'orbitale moléculaire occupée la plus élevée» tandis que le terme LUMO signifie «l'orbital moléculaire inoccupé le plus bas». Nous les appelons «Frontier Orbitals». Une orbitale moléculaire donne l'emplacement le plus probable d'un électron dans un atome. Les orbitales moléculaires se forment à partir de la combinaison d'orbitales atomiques de deux atomes séparés afin de partager leurs électrons. Ce partage d'électrons forme une liaison covalente entre les atomes. Lors de la formation de ces orbitales moléculaires, elles se divisent en deux formes sous le nom de Homo et Lumo.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Homo
3. Qu'est-ce que Lumo
4. Comparaison côte à côte - Homo vs lumo sous forme tabulaire
5. Résumé
Qu'est-ce que Homo?
Homo signifie une orbite moléculaire occupée la plus élevée. Les électrons de ces orbitales moléculaires peuvent être donnés aux orbitales moléculaires de type lumo. En effet, ces orbitales moléculaires contiennent des électrons faiblement attachés. Ces orbitales moléculaires sont la forme la plus disponible pour la liaison chimique covalente. La présence de ces orbitales moléculaires est caractéristique des substances nucléophiles.
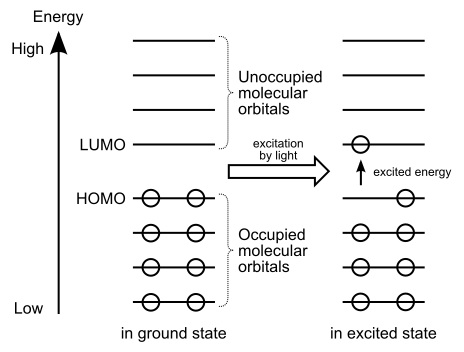
Homo a une faible énergie. Par conséquent, les électrons ont tendance à tenir dans ces orbitales moléculaires; Parce que les électrons essaient d'abord de remplir les faibles niveaux d'énergie. C'est pourquoi nous les appelons «Orbitals occupés». De plus, en présence de lumière, les excitations électroniques peuvent donner des électrons de Homo à Lumo.
Qu'est-ce que Lumo?
LUMO signifie la plus basse orbitale moléculaire inoccupée. Ces orbitales moléculaires peuvent recevoir des électrons de Homo. Comme son nom l'indique, ces orbitales sont inoccupées; Ainsi, ne contient pas d'électrons. En effet. En dehors de cela, ces orbitales moléculaires sont caractéristiques des substances électrophiles.

Figure 01: Le transfert d'électrons de Homo à Lumo
De plus, si nous fournissons de l'énergie légère, les électrons de Homo peuvent être excités et déménager à Lumo. C'est pourquoi nous disons que Lumo peut recevoir des électrons.
Quelle est la différence entre Homo et Lumo?
Homo signifie orbital moléculaire occupé. Ces deux formes d'orbitales sont importantes dans la liaison chimique covalente, en particulier dans la formation de liaisons PI. En tant que différence clé entre Homo et Lumo, nous pouvons dire que l'Homo peut donner des électrons tandis que le lumo peut recevoir des électrons. De plus, la présence d'Homo est caractéristique pour les nucléophiles tandis que la présence de LUMO est caractéristique pour les électrophiles.
L'infographie ci-dessous présente plus de détails sur la différence entre Homo et Lumo.
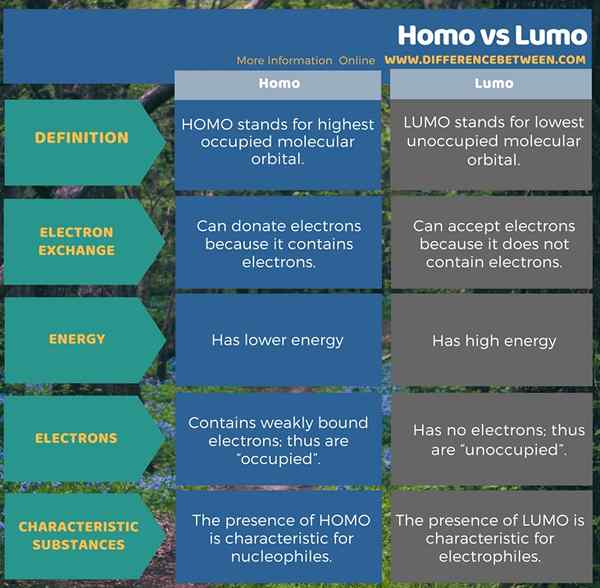
Résumé -Homo vs Lumo
La théorie orbitale moléculaire frontalière explique la formation d'orbitales moléculaires de type homo et lumo. Bien qu'il existe plusieurs différences entre ces deux types, la principale différence entre Homo et Lumo est que Homo donne des électrons alors que Lumo reçoit des électrons.
Référence:
1. Hunt, Ian R. «CH 10: Introduction à la théorie du MO.»CH 13 - Bases RMN. Disponible ici
2. «Introduction à la théorie orbitale moléculaire.”Indicateurs acid_base, Henry Rzepa. Disponible ici
Image gracieuseté:
1.«Molecule Homo-Lumo Diagram» par Tomgally (domaine public) via Commons Wikimedia


