Différence entre les halogènes et les halogénures

Le différence clé entre les halogènes et les halogénures est que le Les halogènes sont des éléments chimiques ayant un électron non apparié dans leur orbitale P le plus à l'extérieur alors que les halogénures n'ont pas d'électrons non appariés.
Les halogènes sont les éléments du groupe 7. Puisqu'ils ont un électron non apparié dans les orbitales P, l'état d'oxydation le plus courant des halogènes est -1 car ils peuvent devenir stables en obtenant un électron. Cet électron gagnant forme un halide. Par conséquent, les halogénures sont la forme anionique des halogènes.
CONTENU
1. Aperçu et différence clé
2. Que sont les halogènes
3. Que sont les halogénures
4. Comparaison côte à côte - Halogènes vs halogénures sous forme tabulaire
5. Résumé
Que sont les halogènes?
Les halogènes sont des éléments chimiques du groupe 7 ayant 5 électrons dans l'orbital p de la plus externe. De plus, ces éléments ont un électron non apparié dans leur orbitale p plus externe. Par conséquent, il est très réactif d'obtenir un électron de l'extérieur et de devenir stable. Ils forment facilement la forme anionique, halogénure, en obtenant un électron.

Figure 01: Apparence des halogènes. (De gauche à droite: chlore, brome, iode.)
Les membres de ce groupe sont du fluor (F), du chlore (CL), du brome (BR), de l'iode (i) et de l'astatine (AT). De plus, la raison de leur donner le nom halogène est qu'ils peuvent tous former des sels de sodium avec des propriétés similaires. Nous pouvons voir toutes les phases de la matière au sein de ce groupe; Le fluor et le chlore sont des gaz dans la nature, le brome est un liquide et l'iode est un composé solide dans des conditions normales. Astatine est un élément radioactif. De plus, la configuration d'électrons générale de ces éléments est ns2NP5.
Que sont les halogénures?
Les halogénures sont les formes anioniques des halogènes. Par conséquent, ces espèces chimiques se forment lorsqu'un halogène gagne un électron de l'extérieur pour obtenir une configuration d'électrons stable. Alors la configuration électronique devient ns2NP6. Cependant, un halogénure aura toujours une charge négative. Les membres de ce groupe incluent le fluorure (F-), chlorure (Cl-), bromure (br-), iodure (je-) et astatine (à-). Les sels ayant ces ions sont des sels d'alidés. De plus, tous ces halogénures sont incolores et se produisent dans des composés cristallins solides. Ces solides ont une forte enthalpie négative de formation. Par conséquent, cela signifie que ces solides se forment facilement.
Il existe des tests spécifiques à partir desquels nous pouvons identifier la présence d'un halogénure. Par exemple, nous pouvons utiliser du nitrate d'argent pour indiquer la présence de chlorures, de bromures et d'iodures. En effet. Si nous ajoutons du nitrate d'argent à une solution contenant du bromure, un précipité de bromure d'argent crémeux se forme. Pour les solutions contenant des ions d'iodure, il donne un précipité de couleur verte. Mais, nous ne pouvons pas identifier le fluorure de ce test car les fluorures ne peuvent pas former des précipités avec du nitrate d'argent.
Quelle est la différence entre les halogènes et les halogénures?
Les halogènes sont les éléments chimiques du groupe 7 ayant 5 électrons dans l'orbital p le plus externe, y compris un électron non apparié. Les halogénures sont les formes anioniques d'halogènes et n'ont pas d'électrons non appariés. C'est la principale différence entre les halogènes et les halogénures. De plus, les membres du groupe halogène sont du fluor (F), du chlore (CL), du brome (BR), de l'iode (I) et de l'astatine (AT). D'un autre côté, les membres du groupe Halide sont du fluorure (F-), chlorure (Cl-), bromure (br-), iodure (je-) et astatine (à-). Ci-dessous est la différence détaillée entre les halogènes et les halogénures sous forme tabulaire.
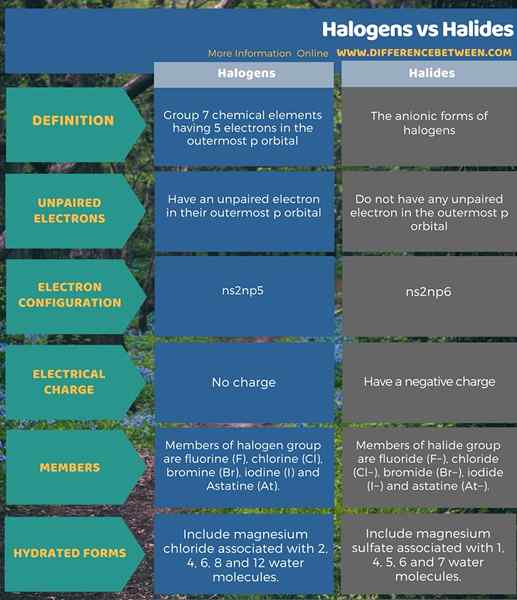
Résumé -Halogènes vs halogénures
Les halogènes sont des éléments du groupe 7 ayant un électron non apparié à l'orbitale extérieur. Ils se forment en halogénures en gagnant un électron et en devenant stable. Par conséquent, la principale différence entre les halogènes et les halogénures est que les halogènes sont des éléments chimiques ayant un électron non apparié dans leur orbitale p le plus à l'extérieur alors que les halogénures n'ont pas d'électrons non appariés.
Référence:
1. «Halogine.»Wikipedia, Wikimedia Foundation, 27 juin 2018. Disponible ici
2. Christe, Karl, et al. «Élément halogène.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 novembre. 2017. Disponible ici
Image gracieuseté:
1.'Halogens' par W. Oelen - Science Maid Live: Chemistry, (CC BY-SA 3.0) via Commons Wikimedia


