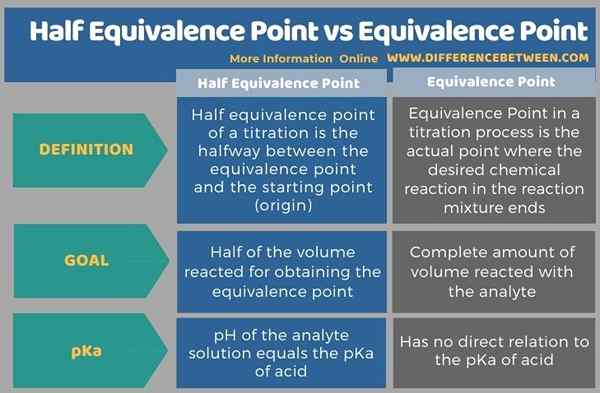
Différence entre le point de la moitié d'équivalence et le point d'équivalence
Le différence clé entre la moitié du point d'équivalence et le point d'équivalence est que Le point de demi-équivalence est le point médian entre le point de départ et le point d'équivalence d'un titrage particulier alors que le point d'équivalence est l'endroit où la réaction chimique se termine.
Les titrages sont des techniques analytiques en chimie qui sont importantes pour déterminer les concentrations inconnues d'échantillons donnés.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point d'équivalence
3. Qu'est-ce que le point de moitié d'équivalence
4. Comparaison côte à côte - Point d'équivalence à moitié vs point d'équivalence dans la forme tabulaire
5. Résumé
Qu'est-ce que le point de moitié d'équivalence?
Le point de semi-équivalence d'un titrage est à mi-chemin entre le point d'équivalence et le point de départ (origine). L'importance de ce point est qu'à ce stade, le pH de la solution d'analyte est égal à la constante de dissociation ou à la PKA de l'acide utilisé dans le titrage. Le point de demi-équivalence se produit à la moitié du volume du premier point d'équivalence du titrage. S'il y a plusieurs points d'équivalence dans le titrage, il y a plusieurs demi-points d'équivalence qui sont égaux au nombre de points d'équivalence. Par exemple, un point d'équivalence en deuxième mi-temps se produit au milieu entre les premiers et deuxième points d'équivalence.
Qu'est-ce que le point d'équivalence?
Le point d'équivalence dans un titrage est le point réel où la réaction chimique souhaitée dans le mélange réactionnel se termine. Nous faisons généralement des titrages pour déterminer la concentration d'une substance dans un liquide. Si nous connaissons la substance, un titrant (une solution utilisée pour déterminer la concentration d'un composant dans un mélange liquide) ayant une concentration connue peut être utilisée pour réagir avec l'analyte. Ici, nous appelons le titrant comme une solution standard car sa molarité exacte est connue.

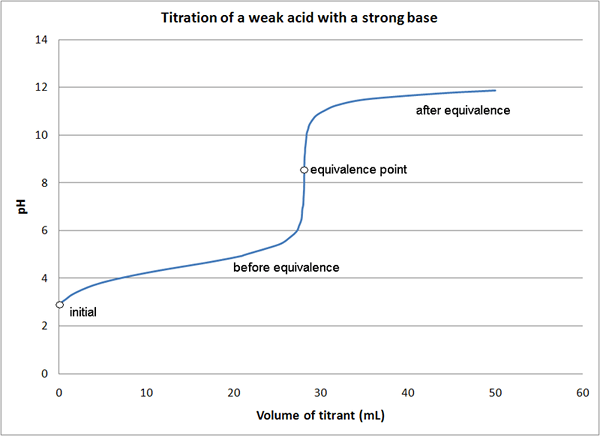
Figure 01: courbe de titration indiquant le point d'équivalence
Dans la réaction entre NaOH et HCl, qui est une réaction acide-base, nous pouvons utiliser NaOH ou HCl comme titrant ayant la concentration connue. Ici, le titrant est placé dans la bureautte, et lentement nous pouvons l'ajouter au titrand / analyte jusqu'à ce qu'un changement de couleur se produit dans le mélange réactionnel. Nous devons utiliser un indicateur car NaOH et HCL ne sont pas des auto-indicateurs. Le point où un changement de couleur se produit est le point final du titrage, qui n'est pas le point d'équivalence de la réaction.
Dans ce titrage, le point d'équivalence est le point où toutes les molécules HCL ont réagi avec NaOH (ou le point où toutes les molécules de NaOH ont réagi avec HCL). Ensuite, les moles de titrant doivent être égales aux moles de l'analyte inconnu car la stoechiométrie entre HCl et NaOH est 1: 1. Il existe différentes méthodes pour déterminer le point d'équivalence d'un titrage.
- Changement de couleurs des auto-indicateurs - Dans les réactions impliquant des autodidicateurs comme réactifs, le changement de couleur révèle le point d'équivalence du titrage car ils n'utilisent pas d'indicateurs.
- Point final- Parfois, le point d'équivalence peut être considéré comme le point final car ils sont approximativement égaux.
- Conductance- Dans cette méthode, la conductance est mesurée tout au long du titrage, et le point d'équivalence est où un changement rapide de conductance se produit. C'est une méthode quelque peu difficile.
- Spectroscopie- Ceci est une méthode adaptée aux mélanges de réaction colorés. Le point d'équivalence est déterminé en fonction du changement rapide des longueurs d'onde absorbées par l'échantillon.
Quelle est la différence entre le point de la moitié d'équivalence et le point d'équivalence?
Les titrages sont des techniques analytiques en chimie qui sont importantes pour déterminer les concentrations inconnues d'échantillons donnés. La principale différence entre le point de la moitié d'équivalence et le point d'équivalence est que le demi-point d'équivalence est le point médian entre le point de départ et le point d'équivalence d'un titrage particulier alors que le point d'équivalence est l'endroit où la réaction chimique se termine.
La tabulation ci-dessous résume la différence entre le point de la demi-équivalence et le point d'équivalence.
Résumé - Point d'équivalence à moitié vs point d'équivalence
Les titrages sont des techniques analytiques en chimie qui sont importantes pour déterminer les concentrations inconnues d'échantillons donnés. La principale différence entre le point de la moitié d'équivalence et le point d'équivalence est que le point de moitié d'équivalence est le point médian entre le point de départ et le point d'équivalence d'un titrage particulier alors que le point d'équivalence est l'endroit où la réaction chimique se termine.
Référence:
1. «Courbes de titrage et point d'équivalence (article)." Académie Khan, Disponible ici.
Image gracieuseté:
1. «Titrage de l'acide faible avec une base forte» par quantumkinetics - propre travail (CC par 3.0) via Commons Wikimedia


