Différence entre H2S et SO2
Le différence clé Entre H2S et SO2 est que H2S a l'odeur d'un œuf pourri, tandis que SO2 a l'odeur d'un match brûlé.
H2S et SO2 sont des composés gazeux à température ambiante. Ces composés contiennent des atomes de soufre. H2S est un hydrure de soufre tandis que SO2 est un oxyde de soufre. De plus, ces deux gaz ont une odeur piquante.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que H2S
3. Qu'est-ce que SO2
4. Comparaison côte à côte - H2S vs SO2 sous forme tabulaire
5. Résumé
Qu'est-ce que H2S?
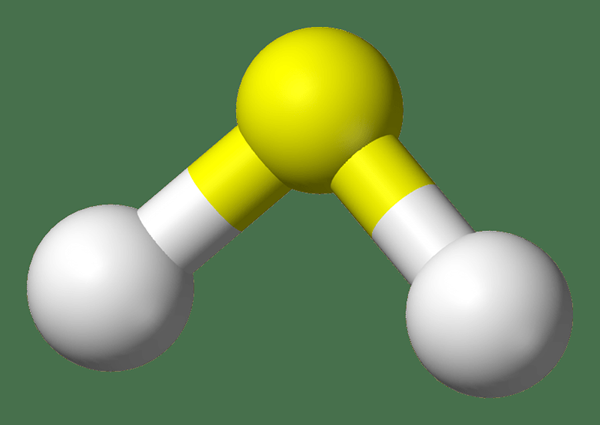
H2S est du sulfure d'hydrogène. C'est un gaz à température ambiante, ayant l'odeur d'un œuf pourri. Par conséquent, il a une odeur piquante et irritante. Ce gaz est très toxique. De plus, il est également corrosif et inflammable. Par conséquent, nous devons le gérer attentivement. La masse molaire de H2S est 38.09 g / mol. Il apparaît comme un gaz incolore.
Le gaz H2S est légèrement plus dense que l'air atmosphérique normal. Cependant, un mélange d'air et de H2S peut provoquer des réactions explosives. De plus, ce gaz brûle dans l'air avec une flamme bleue sur la présence d'oxygène gazeux. Cette réaction donne le SO2 et l'eau. Généralement, le gaz H2S agit comme un agent réducteur car il ne peut subir qu'une oxydation car l'atome de soufre dans ce composé est dans son état d'oxydation le moins (ne peut pas être réduit).

Figure 01: Structure du gaz H2S
Nous pouvons utiliser H2S pour obtenir le soufre élémentaire. La réaction entre H2S et SO2 en présence d'un catalyseur et d'une température élevée donne le soufre élémentaire et l'eau. C'est une méthode importante pour éliminer les H2. De plus, H2S est légèrement soluble dans l'eau et lors de la dissolution, il peut former un acide faible.
H2S peut réagir avec les métaux et former des sulfures métalliques. Ces sulfures métalliques sont des composés insolubles dans l'eau ayant des couleurs sombres. Par exemple, nous pouvons utiliser un papier appliqué en acétate de plomb (ii) pour détecter le H2S évoluant à partir d'un échantillon car le plomb dans le papier peut réagir avec H2S formant du sulfure de plomb de couleur noire.
Qu'est-ce que SO2?
SO2 est le dioxyde de soufre. C'est un gaz toxique qui est incolore et qui a l'odeur des allumettes brûlées. Dans la nature, ce gaz est évolué à partir d'éruptions volcaniques. La masse molaire de ce gaz est 64.8 g / mol. Il est légèrement soluble dans l'eau et lors de la dissolution, il forme de l'acide sulfureux. De plus, ce gaz peut subir à la fois des réactions d'oxydation et de réduction car l'atome de soufre dans cette molécule se situe entre les états d'oxydation les moins et les plus élevés qu'un atome de soufre peut montrer. Par conséquent, SO2 peut agir à la fois comme un agent réducteur et comme un agent oxydant.
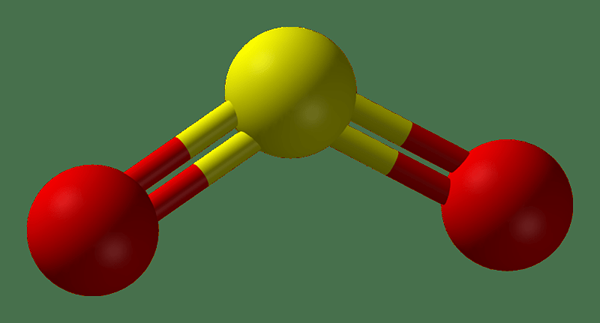
Figure 02: Structure du gaz SO2
Lorsque vous envisagez la production de SO2, il est principalement produit à partir de la fabrication d'acide sulfurique. De plus, le gaz SO2 est le produit du soufre brûlant (ou du matériau de combustion contenant du soufre). De plus, ce gaz est un sous-produit de la fabrication de ciment de silicate de calcium. Nous pouvons produire SO2 à partir de la réaction d'une base aqueuse avec SO2.
Quelle est la différence entre H2S et SO2?
H2S et SO2 sont des composés gazeux à température ambiante. La principale différence entre H2S et SO2 est que H2S a l'odeur d'un œuf pourri, tandis que SO2 a l'odeur d'un match brûlé. Par conséquent, ces deux gaz ont une odeur piquante. En outre, nous pouvons produire des H2S via la séparation du gaz acide alors que nous pouvons produire SO2 comme sous-produit de la fabrication d'acide sulfurique.
Lorsque vous envisagez les utilisations de ces gaz, nous pouvons utiliser H2S pour la production de soufre élémentaire, dans l'analyse qualitative des métaux, comme précurseur des sulfures métalliques, etc., tandis que le SO2 est utile comme précurseur de l'acide sulfurique, comme additif alimentaire, comme agent réducteur, en vinification, etc.
L'infographie ci-dessous résume la différence entre H2S et SO2.
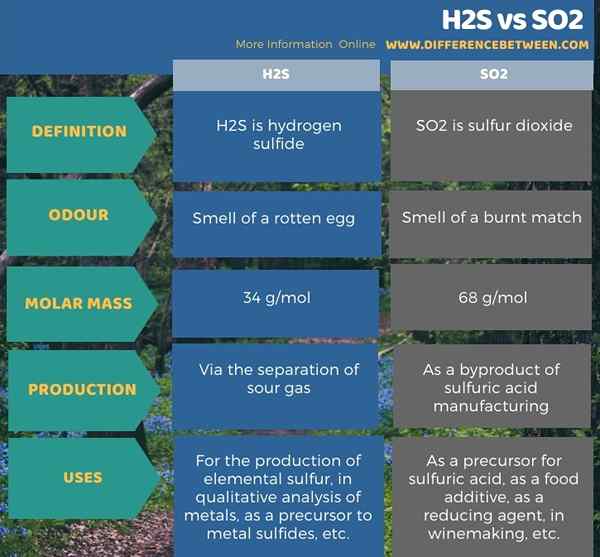
Résumé - H2S vs SO2
H2S et SO2 sont des composés gazeux à température ambiante. La principale différence entre H2S et SO2 est que H2S a l'odeur d'un œuf pourri, tandis que SO2 a l'odeur d'un match brûlé.
Référence:
1. Helmenstine, Anne Marie, «10 faits de soufre intéressants.”Thoughtco, oct. 8, 2019, disponible ici.
Image gracieuseté:
1. «Hydrogène-Sulfide-3D-balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
2. «Soufre-dioxyde-3D-balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


