Différence entre l'acide nitrique fumant et l'acide nitrique concentré

Le différence clé entre l'acide nitrique furieux et l'acide nitrique concentré est que le L'acide nitrique fumant forme une fumée incolore, jaunâtre ou brunâtre tandis que l'acide nitrique concentré ne forme généralement pas de fumée; Mais une très forte concentration de cet acide peut dégager des fumées de couleur blanche.
L'acide nitrique est un acide très corrosif et dangereux qui a la formule chimique HNO3. De plus, il peut avoir une nature chimique diluée ou concentrée. Quoi qu'il en soit, il a des molécules d'acide nitrique dissous dans l'eau. La réaction entre le dioxyde d'azote et l'eau forme de l'acide nitrique. Mais dans la préparation de l'acide nitrique furieux, nous pouvons le préparer en ajoutant un excès de dioxyde d'azote à l'acide nitrique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide nitrique furieux
3. Qu'est-ce que l'acide nitrique concentré
4. Comparaison côte à côte - acide nitrique fumant vs acide nitrique concentré sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide nitrique furieux?
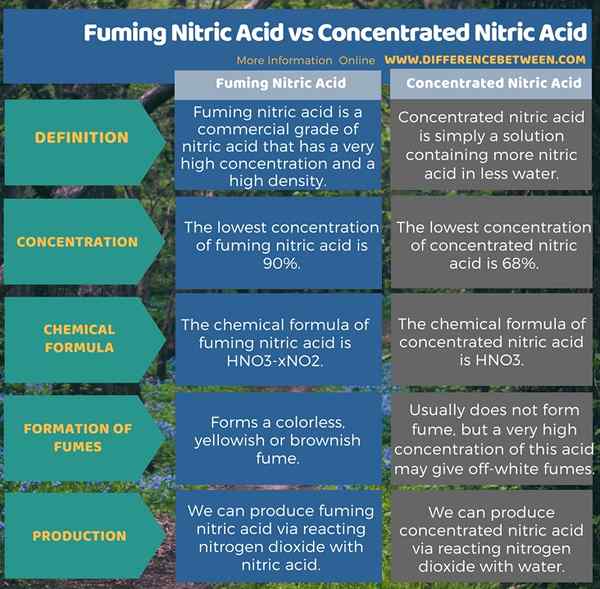
L'acide nitrique fumant est un grade commercial d'acide nitrique qui a une concentration très élevée et une densité élevée. Il contient 90 à 99% HNO3. Nous pouvons préparer ce liquide en ajoutant un dioxyde d'azote excessif à l'acide nitrique. Il forme un liquide furieux incolore, jaunâtre ou brunâtre qui est très corrosif. Par conséquent, cette solution acide a des molécules gazeuses en combinaison avec l'eau; Il n'y a pas d'eau dedans. La fumée de cet acide s'élève de la surface de l'acide; Cela a conduit à son nom, «fumeur». La formule chimique de ce composé est HNO3-XNON2.
De plus, il existe deux formes majeures de cet acide comme acide nitrique furieux blanc et rouge. Par conséquent, nous considérons l'acide fuminant blanc comme la forme la plus pure d'acide nitrique ayant moins de 2%; Parfois, pas d'eau du tout. Ainsi, il est très proche de l'acide nitrique anhydre, et il est disponible en solution à 99%. Il contient un maximum de 0.5% de dioxyde d'azote. Il est utile comme oxydant storable et un propulseur de fusée.

Figure 01: acide nitrique furieux blanc
L'acide nitrique fuminant rouge se compose de 90% HNO3. Il a une teneur élevée en dioxyde d'azote, ce qui fait apparaître la solution dans le brun rougeâtre. Il a une densité inférieure à 1.49 g / cm3. Ainsi, il est également utile comme un oxydant storable et un propulseur de fusée. Pour préparer cet acide, nous pouvons utiliser 84% d'acide nitrique et 13% de tétroxyde de dinitrogen avec 2% d'eau.
Les usages:
- L'acide nitrique fuminant rouge est un composant d'un monopropellant.
- Utile comme carburant unique dans les roquettes.
- En tant qu'oxydants storables.
- L'acide nitrique furieux blanc est utilisé dans la production d'explosifs. Ex: nitroglycérine.
Qu'est-ce que l'acide nitrique concentré?
L'acide nitrique concentré est simplement une solution contenant plus d'acide nitrique dans moins d'eau. Cela signifie que la forme concentrée de cet acide contient une quantité moins d'eau par rapport à la quantité de solutés. À l'échelle commerciale, 68% ou plus est considéré comme un acide nitrique concentré.

Figure 02: 70% d'acide nitrique
De plus, la densité de cette solution est 1.35 g / cm3. Cette grande concentration ne produit pas de fumées, mais la concentration très élevée de cet acide peut dégager des fumées de couleur blanche. Nous pouvons produire ce liquide via la réaction de dioxyde d'azote avec de l'eau.
Quelle est la différence entre l'acide nitrique furieux et l'acide nitrique concentré?
L'acide nitrique fumant est un grade commercial d'acide nitrique qui a une concentration très élevée et une densité élevée. De plus, il forme une fumée incolore, jaunâtre ou brunâtre. La concentration la plus faible de cet acide est de 90%. L'acide nitrique concentré est simplement une solution contenant plus d'acide nitrique dans moins d'eau. La concentration la plus faible de cet acide est de 68%. En plus de cela, cet acide ne forme généralement pas de fumée; Mais la très forte concentration de cet acide peut dégager des fumées de couleur blanche. L'infographie suivante présente plus de détails sur la différence entre l'acide nitrique furieux et l'acide nitrique concentré.
Résumé - Fuming acide nitrique vs acide nitrique concentré
Il existe deux formes d'acide nitrique avec une concentration élevée de HNO3; Ils fusionnent de l'acide nitrique et de l'acide nitrique concentré. La principale différence entre l'acide nitrique fumant et l'acide nitrique concentré est que l'acide nitrique fumant forme une fume incolore, jaunâtre ou brunâtre tandis que l'acide nitrique concentré ne forme généralement pas de fumée; Mais une très forte concentration de cet acide peut dégager des fumées de couleur blanche.
Référence:
1. "Acide nitrique.»Wikipedia, Wikimedia Foundation, 31 juillet 2018. Disponible ici
2. "Acide nitrique.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.'Nitric Acid Fuming' par W. Oelen (CC BY-SA 3.0) via Commons Wikimedia
2.'Nitric Acid 70'By Aleksander Sobolewski via Wikimedia Commons, (CC BY-SA 4.0) via Commons Wikimedia


