Différence entre la substitution des radicaux libres et l'ajout de radicaux libres
Le Différence clé entre la substitution des radicaux libres et l'ajout de radicaux libres est cette substitution radicale libre implique le remplacement d'un groupe fonctionnel par un autre groupe fonctionnel, tandis que l'ajout de radicaux libres implique l'ajout d'un nouveau groupe fonctionnel à une molécule.
Un radical libre peut être un atome, une molécule ou un ion qui se compose d'un électron de valence non apparié. Il existe deux principaux types de réactions radicales: la substitution des radicaux libres et les réactions d'addition de radicaux libres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un radical libre
3. Qu'est-ce que la substitution radicale libre
4. Qu'est-ce que l'ajout de radicaux libres
5. Substitution radicale libre vs addition radicale libre sous forme tabulaire
6. Résumé - Substitution des radicaux libres vs ajout de radicaux libres
Qu'est-ce qu'un radical libre?
Un radical libre peut être un atome, une molécule ou un ion composé d'un électron de valence non apparié. Habituellement, ces électrons non appariés peuvent rendre les radicaux libres très réactifs chimiquement; Cependant, il peut y avoir des exceptions. En raison de leur forte réactivité, la plupart des radicaux libres ont tendance à dimériser spontanément. Par conséquent, ils ont une vie très courte.
Qu'est-ce que la substitution radicale libre?
La substitution des radicaux libres est un type de réaction de substitution qui implique des radicaux libres comme intermédiaire réactif. Les intermédiaires réactifs sont de courte durée, une grande énergie et des molécules réactives élevées. Ces molécules se forment lors d'une réaction chimique qui a tendance à se convertir rapidement en molécules plus stables. De plus, une réaction de substitution est un type de réaction chimique où un groupe fonctionnel dans un composé chimique a tendance à être remplacé par un autre groupe fonctionnel.

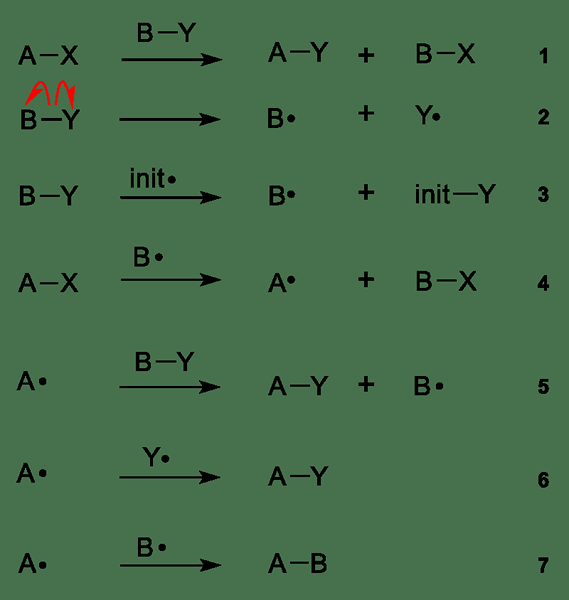
Figure 01: différentes étapes des réactions radicales libres
L'image ci-dessus indique les étapes des réactions radicales libres en général; Les étapes 2 et 3 sont nommées réactions d'initiation où se forment des radicaux libres par l'homolyse. L'homolyse peut être obtenue en utilisant la chaleur ou la lumière UV et en utilisant des initiateurs radicaux, E.g. peroxydes organiques, composés azo, etc. Les dernières étapes 6 et 7 sont collectivement nommées comme terminaison; Ici, le radical a tendance à se recombiner avec une autre espèce radicale. Cependant, le radical réagit parfois davantage où la propagation se produit. La propagation est donnée à partir des étapes 4 et 5 dans l'image ci-dessus.
Certains exemples de réactions de substitution radicale comprennent la désoxygénation de Barton-McCombie, la réaction de Wohl-Ziegler, la réaction Dowd-Beck avec, etc.
Qu'est-ce que l'ajout de radicaux libres?
L'ajout de radicaux libres est un type de réaction d'addition où un groupe fonctionnel est ajouté à un composé à travers un intermédiaire réactif radical libre. Ce type d'addition peut se produire entre une espèce radicale et non radicale ou entre deux espèces radicales. Les étapes de base de l'ajout de radicaux libres comprennent l'initiation, la propagation de la chaîne et la terminaison de la chaîne.
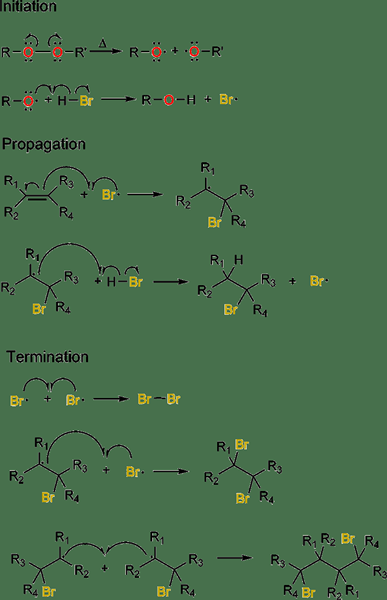
Figure 02: Ajout radical de HBR sur les alcènes
Au cours du processus d'initiation, un initiateur radical est utilisé pour l'initiation, où une espèce radicale se forme à partir d'un précurseur non radical. Pendant le processus de propagation de la chaîne, un radical libre a tendance à réagir avec une espèce non radicale afin de produire une nouvelle espèce radicale. La dernière étape est la terminaison de la chaîne, où les deux radicaux réagissent les uns avec les autres, créant une espèce non radicale. Un exemple commun de ce type de réaction comprend l'arylation de Meerwein.
En règle générale, les réactions d'addition radcal libre sont basées sur les réactifs ayant des liaisons faibles afin qu'ils puissent subir une homolyse formant des espèces radicales. Lorsqu'il y a des liaisons fortes, le mécanisme de réaction devient différent des réactions d'addition de radicaux libres habituels.
Quelle est la différence entre la substitution des radicaux libres et l'ajout de radicaux libres?
Un radical libre peut être un atome, une molécule ou un ion composé d'un électron de valence non apparié. La principale différence entre la substitution des radicaux libres et l'ajout de radicaux libres est que la substitution des radicaux libres implique le remplacement d'un groupe fonctionnel par un autre groupe fonctionnel, tandis que l'ajout de radicaux libres implique l'ajout d'un nouveau groupe fonctionnel à une molécule.
La figure suivante répertorie les différences entre la substitution des radicaux libres et l'ajout de radicaux libres sous forme tabulaire pour une comparaison côte à côte.
Résumé - Substitution des radicaux libres vs ajout de radicaux libres
Un radical libre peut être un atome, une molécule ou un ion composé d'un électron de valence non apparié. La principale différence entre la substitution des radicaux libres et l'ajout de radicaux libres est que la substitution des radicaux libres implique le remplacement d'un groupe fonctionnel par un autre groupe fonctionnel, tandis que l'ajout de radicaux libres implique l'ajout d'un nouveau groupe fonctionnel à une molécule.
Référence:
1. «Qu'est-ce que la substitution radicale libre?" Chemistry LibreTexts, LibreTexts, 13 septembre. 2020, disponible ici.
Image gracieuseté:
1. «FreeradicalSubstitutionGeneralDescr (1)» par V8rik à English Wikipedia (CC BY-SA 3.0) via Commons Wikimedia
2. «Peroxyde Free-Radical-Addition» par Bryn C - transféré de EN (domaine public) via Commons Wikimedia


