Différence entre le ferrique et le sulfate ferreux

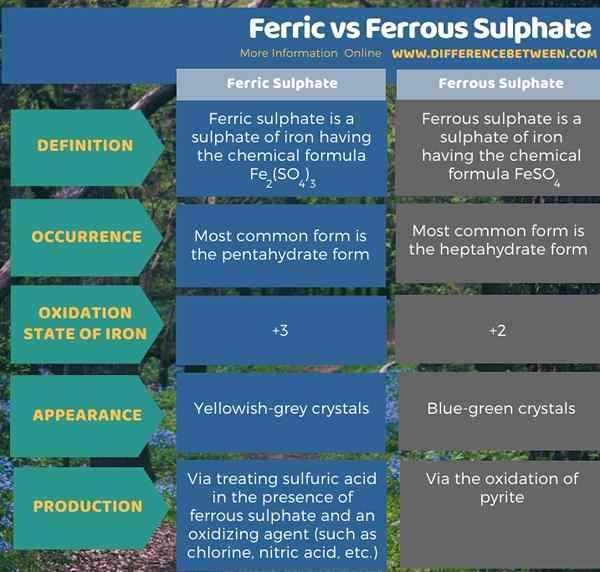
Le différence clé entre le sulfate ferrique et ferreux est que Le sulfate ferrique a du fer à l'état d'oxydation +3, tandis que le sulfate ferreux a du fer à l'état d'oxydation +2.
Ferric et ferreux sulfate sont des sulfates de fer. Ce sont des composés ioniques contenant des cations (fer dans différents états d'oxydation) et des anions (anions sulfate). La formule chimique du sulfate ferrique est Fe2(DONC4)3 tandis que la formule chimique du sulfate ferreux est feso4.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le sulfate ferrique
3. Qu'est-ce que le sulfate ferreux
4. Comparaison côte à côte - ferrique vs sulfate ferreux sous forme tabulaire
5. Résumé
Qu'est-ce que le sulfate ferrique?
Le sulfate ferrique est un sulfate de fer ayant la formule chimique Fe2(DONC4)3. Le fer dans ce composé est dans l'état d'oxydation +3. Le nom chimique est le sulfate de fer (iii). Il est soluble dans l'eau et apparaît généralement dans les cristaux de couleur jaunâtre-gris. Il existe une forme anhydre ainsi que certaines formes hydratées. La masse molaire de la forme anhydre est 399.9 g / mol. Cependant, la forme anhydre se produit très rarement dans la nature. La forme pentahydrate (ayant cinq molécules d'eau associées à une molécule de sulfate ferrique) est la forme la plus courante.

Figure 01: Aspect du sulfate ferrique
Dans le processus de production, ce composé est obtenu comme une solution plutôt que comme un solide. La production à grande échelle implique de traiter l'acide sulfurique en présence de sulfate ferreux et d'un agent oxydant (comme le chlore, l'acide nitrique, etc.)
Qu'est-ce que le sulfate ferreux?
Le sulfate ferreux est un sulfate de fer ayant la formule chimique feso4. Le fer dans ce composé est à l'état d'oxydation +2. Le nom chimique du sulfate ferreux est le sulfate de fer (ii). Il existe à la fois des formes anhyaires et des formes hydratées. La forme la plus courante est la forme heptahydrate. Il a sept molécules d'eau associées à une molécule de sulfate ferreuse. Cette forme heptahydrate se produit sous forme de cristaux bleu-vert.

Figure 02: cristaux heptahydrates de sulfate ferreux
Le sulfate ferreux est préparé commercialement par oxydation de la pyrite. Cependant, une autre méthode qui produit ce composé en grande quantité en tant que sous-produit est la finition de l'acier. Ici, la feuille d'acier passe à travers un bain de décapage contenant de l'acide sulfurique.
Quelle est la différence entre le sulfate ferrique et ferreux?
Ferric et ferreux sulfate sont des sulfates de fer. La principale différence entre le sulfate ferrique et ferreux est que le sulfate ferrique a du fer à l'état d'oxydation +2, tandis que le sulfate ferreux a du fer dans l'état d'oxydation +3. Le sulfate ferrique est un sulfate de fer ayant la formule chimique Fe2(DONC4)3 tandis que le sulfate ferreux est un sulfate de fer ayant la formule chimique feso4. Les formes anhyaires de ces composés sont rares; Par conséquent, nous pouvons trouver la forme hydratée la plus courante de sulfate ferrique comme la forme pentahydratée; La forme la plus courante de sulfate ferreuse est la forme heptahydrate.
De plus, la forme hydratée la plus courante de sulfate ferrique apparaît dans les cristaux de gris jaunâtre tandis que le sulfate ferreux apparaît sous forme de cristal bleu-vert. Par conséquent, c'est une différence facilement distincable entre le sulfate ferrique et ferreux. Lorsque vous envisagez le processus de production, nous pouvons produire du sulfate ferrique en traitant de l'acide sulfurique en présence de sulfate ferreux et d'un agent oxydant (comme le chlore, l'acide nitrique, etc.). En attendant, nous pouvons produire du sulfate ferreux par oxydation de la pyrite. Cependant, une autre méthode qui produit ce composé en grande quantité en tant que sous-produit est la finition de l'acier.
Résumé - Ferric vs sulfate ferreux
Ferric et ferreux sulfate sont des sulfates de fer. La principale différence entre le sulfate ferrique et ferreux est que le sulfate ferrique a du fer à l'état d'oxydation +2, tandis que le sulfate ferreux a du fer dans l'état d'oxydation +3.
Référence:
1.«Sulfate ferrique.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
2. «Fer (ii) sulfate.»Wikipedia, Wikimedia Foundation, 18 septembre. 2019, disponible ici.
3. «Sulfate de fer (III).»Wikipedia, Wikimedia Foundation, 23 septembre. 2019, disponible ici.
4. «Composés.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 13 juin 2019, disponible ici.
Image gracieuseté:
1. «Síran Železitý» par Ondřej Manggl - propre travail (domaine public) via Commons Wikimedia
2. «Iron (II) -Sulfate-Heptahydrate-échantillon» par Benjah-Bmm27 - Propre travaux (domaine public) via Commons Wikimedia