Différence entre le chlorure d'éthyle et le chlorobenzène
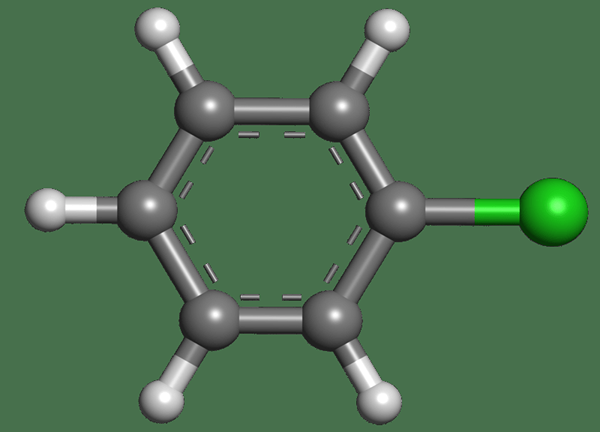
Le différence clé entre le chlorure d'éthyle et le chlorobenzène est que Le chlorure d'éthyle est aliphatique, tandis que le chlorobenzène est aromatique.
Le chlorobenzène a un anneau de benzène avec un atome de chlore qui y est attaché. Ici, l'atome de chlore a remplacé l'un des atomes d'hydrogène de l'anneau. Par conséquent, le nuage d'électrons délocalisé de l'anneau de benzène est également là. Pendant ce temps, le chlorure d'éthyle est un composé aliphatique qui n'a pas de structures annulaires.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorure d'éthyle
3. Qu'est-ce que le chlorobenzène
4. Comparaison côte à côte - chlorure d'éthyle vs chlorobenzène sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorure d'éthyle?
Le chlorure d'éthyle est un composé organique avec la formule chimique C2H5CL. Il a la structure de l'éthane avec l'un de ses atomes d'hydrogène remplacé par un atome de chlore. Il se produit sous forme de gaz incolore et inflammable, et nous pouvons le maintenir sous la forme liquide lorsqu'il est réfrigéré. En outre, ce composé est couramment utilisé comme additif à l'essence.
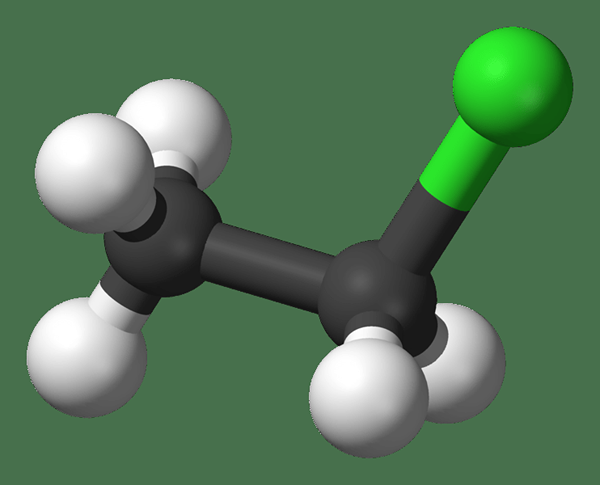
De plus, sa masse molaire est de 64.51 g / mol. Il a une odeur piquante et éthérée. Le point de fusion est −138.7 ° C, et le point d'ébullition est 12.27 ° C. De plus, nous pouvons produire ce composé via le chloration chlorhydienne de l'éthane. La réaction est la suivante:
C2H4 + HCl → C2H5CL
Qu'est-ce que le chlorobenzène?
Le chlorobenzène est un composé organique aromatique qui a un anneau de benzène avec un atome de chlore attaché. La formule chimique de ce composé est C6H5CL. C'est un liquide incolore et inflammable. Mais, il a une odeur d'amande. La masse molaire est 112.56 g / mol. Le point de fusion de ce composé est de -45 ° C tandis que le point d'ébullition est de 131 ° C.
De plus, lorsque vous envisagez les utilisations de ce composé, il est très important en tant qu'intermédiaire dans la production de composés tels que les herbicides, le caoutchouc, etc. De plus, c'est un solvant d'ébullition élevé que nous utilisons dans des applications industrielles.

De plus, nous pouvons produire du chlorobenzène par chloration du benzène en présence d'acides Lewis tels que le chlorure ferrique, le dichlorure de soufre, etc. Ici, l'acide Lewis agit comme le catalyseur de la réaction. Il peut améliorer l'électrophilicité du chlore. De plus, puisque le chlore est électronégatif, le chlorobenzène a tendance à ne pas subir de chloration. Plus important encore, ce composé montre une toxicité faible à modérée. Cependant, si ce composé entre dans notre corps en respirant, nos poumons et notre système urinaire peuvent l'excréter.
Quelle est la différence entre le chlorure d'éthyle et le chlorobenzène?
Le chlorure d'éthyle est un composé organique avec la formule chimique C2H5CL tandis que le chlorobenzène est un composé organique aromatique qui a un anneau de benzène avec un atome de chlore attaché. La principale différence entre le chlorure d'éthyle et le chlorobenzène est que le chlorure d'éthyle est aliphatique, tandis que le chlorobenzène est aromatique.
L'infographie suivante met en évidence la différence entre le chlorure d'éthyle et le chlorobenzène.

Résumé - Chlorure d'éthyle vs chlorobenzène
Le chlorure d'éthyle est un composé organique qui a la formule chimique C2H5CL tandis que le chlorobenzène est un composé organique aromatique qui a un anneau de benzène avec un atome de chlore attaché. En résumé, la principale différence entre le chlorure d'éthyle et le chlorobenzène est que le chlorure d'éthyle est aliphatique, tandis que le chlorobenzène est aromatique.
Référence:
1. «Chloroéthane.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «Chloroethane-3D-balls» par Benjah-Bmm27 - propre travail (domaine public) via Commons Wikimedia
2. «Chlorobenzène» par Marinavladivostok - Own Work (CC0) via Commons Wikimedia


