Différence entre l'équilibre et l'état d'équilibre
Le différence clé entre l'équilibre et l'état d'équilibre est que En équilibre, les concentrations de tous les composants sont maintenues constantes alors que, à l'état d'équilibre, seuls certains composants sont maintenus constants.
Lorsqu'un ou plusieurs réactifs sont convertis en produits, ils peuvent passer par différentes modifications et changements d'énergie. Les liaisons chimiques dans les réactifs sont cassées et de nouvelles liaisons sont formées pour générer des produits totalement différents des réactifs. C'est ce que nous appelons une réaction chimique. L'équilibre et l'état d'équilibre sont des concepts chimiques importants concernant différentes réactions chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équilibre
3. Qu'est-ce que l'état d'équilibre
4. Comparaison côte à côte - Équilibre vs état stable sous forme tabulaire
5. Résumé
Qu'est-ce que l'équilibre?
Certaines réactions sont réversibles, tandis que certaines réactions sont irréversibles. En réaction, les réactifs sont convertis en produits. Dans certaines réactions, les réactifs génèrent à nouveau à partir des produits. Nous nommons ce type de réactions comme réversible. Dans des réactions irréversibles, une fois les réactifs convertis en produits, ils ne se régénèrent pas à partir de produits.
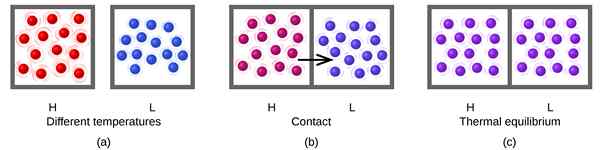
Dans une réaction réversible, lorsque les réactifs sont transformés en produits, nous l'appelons réaction avant. Lorsque les produits sont transformés en réactifs, nous l'appelons une réaction arrière. Lorsque la vitesse des réactions vers l'avant et vers l'arrière est égale, alors la réaction est à l'équilibre. Par conséquent, la quantité de réactifs et de produits ne change pas sur une période de temps.

Figure 01: Équilibre thermique
Les réactions réversibles ont toujours tendance à venir à l'équilibre et à maintenir cet équilibre. Lorsque le système est à l'équilibre, la quantité de produits et les réactifs ne doivent pas nécessairement être égaux. Il peut y avoir une quantité plus élevée de réactifs que les produits ou vice versa. La seule exigence d'une équation d'équilibre est de maintenir une quantité constante des deux dans le temps. Pour une réaction en équilibre, nous pouvons définir une constante d'équilibre, qui est égale au rapport entre la concentration de produits et la concentration des réactions.
Qu'est-ce que l'état d'équilibre?
Considérer une réaction dans laquelle le réactif A passe au produit C via un b intermédiaire. Dans une réaction comme celle-ci, B est formé par A, puis il subit une déplétion pour former C. Avant le début de la réaction, il n'y a que A et B commence lentement à s'accumuler. Cependant, avec le temps, le montant de A est réduit et C est augmenté, mais la quantité de B reste approximativement la même dans le temps. Dans cet état, dès que plus de formes B, il s'épuisera pour donner C à un rythme rapide en maintenant une concentration en régime permanent. Ainsi, le taux de synthèse de b = taux de consommation de b.
A ⟶ b ⟶ c
Hypothèse à l'état d'équilibre: d (b) / dt = 0.
Quelle est la différence entre l'équilibre et l'état d'équilibre?
L'équilibre et l'état d'équilibre sont des concepts chimiques importants. La principale différence entre l'équilibre et l'état d'équilibre est que dans l'équilibre, les concentrations de tous les composants sont maintenues constantes alors que, à l'état d'équilibre, seuls certaines composants sont maintenus constants. En équilibre, les concentrations de composants sont constantes car les taux de réaction sont égaux dans la réaction avant et arrière. À l'état d'équilibre, seuls certains composants sont constants car son taux de synthèse et son taux de consommation sont égaux. Pour cela, les réactions ne doivent pas nécessairement être en équilibre.
Résumé - Équilibre vs état d'équilibre
L'équilibre et l'état d'équilibre sont des concepts chimiques importants. La principale différence entre l'équilibre et l'état d'équilibre est que dans l'équilibre, les concentrations de tous les composants sont maintenues constantes alors que, à l'état d'équilibre, seuls certains composants sont maintenus constants.
Référence:
1.Helmenstine, Anne Marie. «Équilibre chimique dans les réactions chimiques."Thoughtco, février. 3, 2019, disponible ici.
Image gracieuseté:
1. «CNX Chem 05 01 HeatTrans1» par OpenStax - (CC par 4.0) via Commons Wikimedia


