Différence entre la liaison électrovalente et covalente
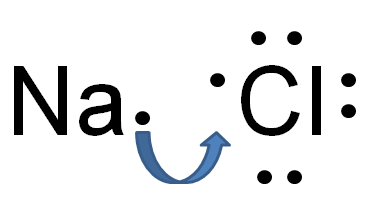
La principale différence entre la liaison électrovalente et covalente est que La liaison électrovalente se produit en transférant des électrons d'un atome à un autre alors que La liaison covalente se produit à la suite du partage d'électrons de valence entre les atomes. Une liaison ionique est également appelée une liaison électrovalente. Les électrons de valence, qui sont des électrons situés dans les coquilles les plus externes d'un atome, sont impliquées dans les deux types de liaison chimique.
La liaison chimique est la clé pour former divers types de composés chimiques. Il agit comme une colle pour maintenir les atomes ou les molécules ensemble. Le but principal de la liaison chimique est de produire un composé chimique stable. Lorsqu'une liaison chimique se forme, l'énergie est libérée, formant un composé stable. Il existe trois principaux types de liaisons chimiques appelées liaison ionique, liaison covalente et liaison métallique ou non covalente.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une liaison électrovalente
3. Qu'est-ce qu'une liaison covalente
4. Comparaison côte à côte - Liaison covalente électrovalente vs
5. Résumé
Qu'est-ce qu'une liaison électrovalente?
La liaison électrovalente ou ionique est un type de liaison chimique qui est formée à la suite du transfert d'électrons d'un atome à un autre. Ce transfert fait que l'un des atomes est chargé de manière positive et l'autre atome est chargé négativement. L'atome du donneur d'électrons devient positivement chargé; Par conséquent, il est appelé le cation alors que l'atome de réception d'électrons devient négativement chargé et est appelé l'anion. Une attraction électrostatique se produit entre ce cation et anion en raison des charges électriques opposées. La grande différence d'électronégativité entre les deux atomes provoque cette liaison. Les atomes métalliques et non métalliques sont impliqués dans cette liaison.
Cependant, aucune des liaisons électrovalentes n'est des liaisons ioniques pures. Chaque composé ionique peut avoir un certain pourcentage de liaison covalente. Ainsi, il révèle qu'un composé ionique a un caractère ionique plus élevé et un faible degré de caractère covalent. Mais il y a des composés avec un degré considérable de caractère covalent. Ce type de liaison est appelé liaisons covalentes polaires.
Les caractéristiques des composés construites à partir de liaison électrovalente sont différentes des composés construits à partir de collage covalent. Lorsque vous envisagez les propriétés physiques, des points d'ébullition et des points de fusion généralement plus élevés peuvent être observés. Mais la solubilité dans l'eau et la propriété de conductivité électrique est considérablement élevée. Des exemples de composés avec des liaisons ioniques peuvent inclure des halogénures de métaux, des oxydes de métaux, des sulfures de métaux, etc.
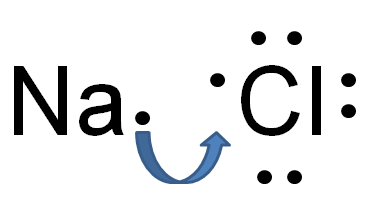
Figure 01: liaison électrovalente
Qu'est-ce qu'une liaison covalente?
Une liaison covalente est un type de liaison chimique qui est formée à la suite du partage des paires d'électrons entre les atomes non métalliques. Ce partage d'électrons se produit en raison d'une faible différence d'électronégativité entre les deux atomes impliqués dans la liaison. Dans la liaison covalente, les atomes non métalliques sont généralement impliqués. Ces atomes ont une configuration d'électrons incomplète dans leurs orbitales externes, partagent ainsi des électrons non appariés afin d'atteindre une configuration d'électrons similaire à un gaz noble. C'est parce que la configuration d'électrons incomplète rend l'atome particulier instable. Contrairement à la liaison ionique, la liaison covalente peut avoir des liaisons doubles simples ou des liaisons triples entre deux atomes. Ces obligations sont formées de telle manière que les deux atomes obéissent à la règle des octets. La liaison se produit via le chevauchement des orbitales atomiques. Une seule liaison est formée lorsque deux électrons sont partagés. Une double liaison est formée lorsque quatre électrons sont partagés. Le partage de six électrons peut entraîner une triple liaison.
Les caractéristiques des composés avec des liaisons covalentes comprennent une forte liaison entre deux atomes en raison de valeurs d'électronégativité similaires. Ainsi, la solubilité et la conductivité électrique (à l'état soluble) sont médiocres ou absentes. Ces composés ont également des points de fusion plus bas et des points d'ébullition par rapport aux composés ioniques. Un certain nombre de composés organiques et inorganiques peuvent être pris comme des exemples de composés avec une liaison covalente.
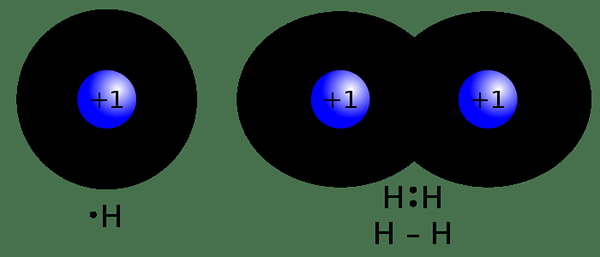
Figure 02: Bond covalent
Quelle est la différence entre la liaison électrovalente et la liaison covalente?
Liaison électrovalente vs liaison covalente | |
| La liaison électrovalente est une liaison chimique entre deux atomes en raison d'un transfert d'électrons d'un atome à l'autre. | La liaison covalente est un type de liaison chimique qui se produit en raison du partage de paires d'électrons entre les atomes. |
| Métaux vs non-métaux | |
| Des liaisons électrovalentes peuvent être observées entre les métaux et les non-métaux. | Les liaisons covalentes peuvent être généralement observées entre deux non-métaux. |
| Différence d'électronégativité | |
| La différence d'électronégativité entre deux atomes est plus élevée dans la liaison électrovalente. | La différence d'électronégativité entre deux atomes est relativement plus faible. |
| Solubilité dans l'eau et la conductivité électrique | |
| La solubilité dans l'eau et la conductivité électrique est plus élevée dans les composés avec une liaison électrovalente. | La solubilité dans l'eau et la conductivité électrique est relativement plus faible dans les composés avec une liaison covalente. |
| Points d'ébullition et de fusion | |
| Les points d'ébullition et de fusion sont plus élevés pour la liaison électrovalente. | Les points d'ébullition et de fusion sont relativement inférieurs pour la liaison covalente. |
Résumé - Liais de liaisons covalentes électrovalents vs
Les liaisons électrovalents et covalentes sont deux types de liaisons chimiques qui sont différentes les unes des autres. La principale différence entre les liaisons électrovalents et covalentes est leur nature; La liaison électrovalente est un type d'attraction électrostatique entre deux atomes alors que la liaison covalente partage des paires d'électrons entre deux atomes.
Référence:
1. «Boulage électrovalent.»Emedicalprep. N.p., n.d. la toile. 25 mai 2017.<>
2.”La liaison covalente .»Groupes de la division de l'éducation chimique. Université Purdue, n.d. la toile. 25 mai 2017.<>
3."Liaisons chimiques.»Khan Academy, n.d. la toile. 25 mai 2017. <>
Image gracieuseté:
1. «NaCl ionic Bond» par Mhowison - propre travail (domaine public) via Commons Wikimedia
2. «Hydrogène de liaison covalente» par Jacek FH - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


