Différence entre l'électronégativité et l'énergie d'ionisation
Le différence clé entre l'électronégativité et l'énergie d'ionisation est que L'électronégativité explique l'attraction des électrons tandis que l'énergie d'ionisation fait référence à l'élimination des électrons d'un atome.
Les atomes sont les éléments constitutifs de toutes les substances existantes. Ils sont si minuscules que nous ne pouvons même pas les observer à l'œil nu. Un atome se compose d'un noyau, qui a des protons et des neutrons. En plus des neutrons et des positrons, il existe d'autres petites particules subatomiques dans le noyau, et il y a des électrons qui tournent autour du noyau en orbitales. En raison de la présence de protons, les noyaux atomiques ont une charge positive. Les électrons de la sphère extérieure ont une charge négative. Par conséquent, les forces attractives entre les charges positives et négatives de l'atome maintiennent sa structure.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'électronégativité
3. Qu'est-ce que l'énergie d'ionisation
4. Comparaison côte à côte - électronégativité par rapport à l'énergie d'ionisation sous forme tabulaire
5. Résumé
Qu'est-ce que l'électronégativité?
L'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui. En d'autres termes, cela montre l'attraction d'un atome vers les électrons. Nous utilisons couramment l'échelle Pauling pour indiquer l'électronégativité des éléments.
Dans le tableau périodique, l'électronégativité change selon un modèle. De gauche à droite sur une période, l'électronégativité augmente, et de haut en bas sur un groupe, l'électronégativité diminue. Par conséquent, le fluor est l'élément le plus électronégatif avec une valeur de 4.0 sur l'échelle Pauling. Les éléments des groupes un et deux ont moins d'électronégativité; Ainsi, ils ont tendance à former des ions positifs en donnant des électrons. Étant donné que les éléments du groupe 5, 6, 7 ont une valeur d'électronégativité plus élevée, ils aiment prendre des électrons dans et en provenance d'ions négatifs.
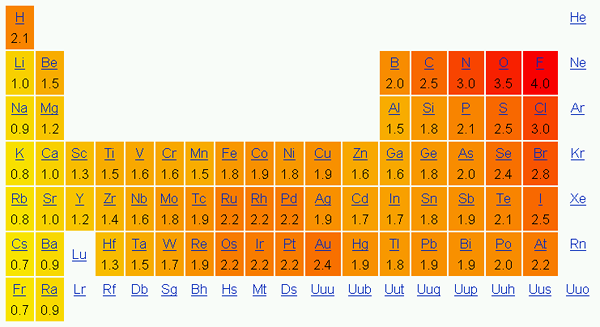
Figure 01: Électronégativité selon l'échelle Pauling
L'électronégativité est également importante pour déterminer la nature des liaisons. Si les deux atomes de la liaison n'ont pas de différence d'électronégativité, alors une liaison covalente pure se formera. De plus, si la différence d'électronégativité entre les deux est élevée, alors une liaison ionique sera le résultat. S'il y a une légère différence, une liaison covalente polaire se forme.
Qu'est-ce que l'énergie d'ionisation?
L'énergie d'ionisation est l'énergie qui doit être donnée à un atome neutre pour en retirer un électron. L'élimination d'un électron signifie l'éliminer une distance infinie de l'espèce afin qu'il n'y ait pas de forces d'attraction entre l'électron et le noyau (élimination complète).
Nous pouvons nommer des énergies d'ionisation comme première énergie d'ionisation, énergie de seconde ionisation, etc., selon le nombre d'électrons retirés de l'atome. Dans le même temps, cela donnera naissance à des cations avec des frais +1, +2, +3, etc.

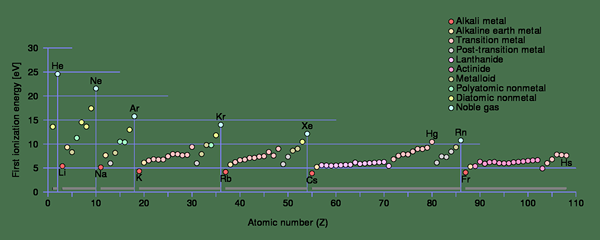
Figure 1: Tendances énergétiques d'ionisation pour la première ionisation à chaque période du tableau périodique
Dans les petits atomes, le rayon atomique est petit. Par conséquent, les forces d'attraction électrostatique entre l'électron et le neutron sont beaucoup plus élevées par rapport à un atome avec un rayon atomique plus grand. Il augmente l'énergie d'ionisation d'un petit atome. Si l'électron est plus proche du noyau, l'énergie d'ionisation sera plus élevée.
De plus, les premières énergies d'ionisation de différents atomes varient également. Par exemple, la première énergie d'ionisation du sodium (496 kJ / mol) est bien inférieure à la première énergie d'ionisation du chlore (1256 kJ / mol). C'est parce qu'en éliminant un électron, le sodium peut gagner la configuration du gaz noble; Par conséquent, il élimine facilement l'électron. De plus, la distance atomique est moins en sodium que dans le chlore, ce qui abaisse l'énergie d'ionisation. Par conséquent, l'énergie d'ionisation augmente de gauche à droite dans une rangée et en bas pour en haut dans une colonne du tableau périodique (c'est l'inverse de l'augmentation de la taille atomique du tableau périodique). Lors du retrait des électrons, il y a des cas où les atomes gagnent des configurations d'électrons stables. À ce stade, les énergies d'ionisation ont tendance à sauter dans une valeur plus élevée.
Différence entre l'électronégativité et l'énergie d'ionisation?
L'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui tandis que l'énergie d'ionisation est l'énergie dont un atome neutre a besoin pour en éliminer un électron. Par conséquent, la principale différence entre l'électronégativité et l'énergie d'ionisation est que l'électronégativité explique l'attraction des électrons tandis que l'énergie d'ionisation se réfère à l'élimination des électrons d'un atome.
De plus, il existe une autre différence significative entre l'électronégativité et l'énergie d'ionisation en fonction de leurs tendances dans le tableau périodique des éléments. L'électronégativité augmente de gauche à droite sur une période et diminue de haut en bas sur un groupe. Tandis que l'énergie d'ionisation augmente de gauche à droite dans une rangée et en bas pour en haut dans une colonne du tableau périodique. Cependant, parfois, les atomes gagnent des configurations d'électrons stables, et donc, les énergies d'ionisation ont tendance à sauter dans une valeur plus élevée.
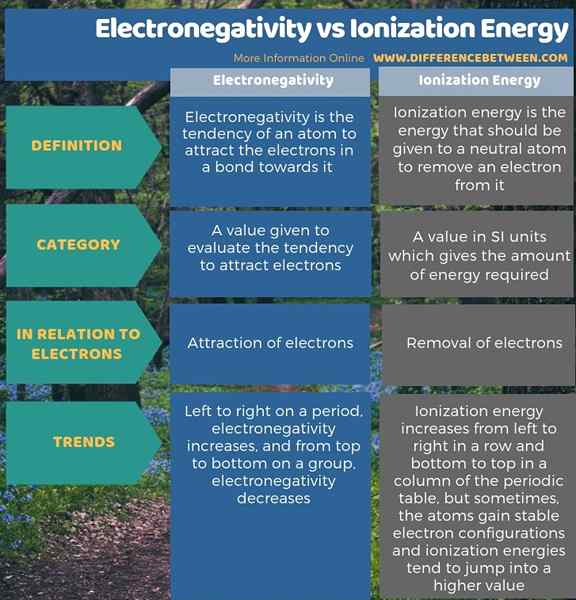
Résumé - Électronégativité vs énergie d'ionisation
Les termes électronégativité et énergie d'ionisation expliquent les interactions entre les noyaux atomiques et les électrons. La principale différence entre l'électronégativité et l'énergie d'ionisation est que l'électronégativité explique l'attraction des électrons tandis que l'énergie d'ionisation se réfère à l'élimination des électrons d'un atome.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemples de l'électronégativité et des exemples.”Thoughtco, oct. 17, 2018, disponible ici.
2. Helmenstine, Anne Marie. «Définition et tendance de l'énergie d'ionisation."Thoughtco, Jan. 24, 2019, disponible ici.
Image gracieuseté:
1. «Taula periòdica electronegativitat» de Joanjoc au catalan Wikipedia - transféré de CA.Wikipedia à Commons (domaine public) via Commons Wikimedia
2. «First Ionisation Energy» par Sponk (fichier PNG) GLRX (fichier SVG) Wylve (Zh-Hans, Zh-Hant) Palosirkka (FI) Michel Djerzinski (VI) Tferenczy (CZ) Obsuder (Sr-Ec, Sr-El, Hr , BS, SH) DePiep (Elements 104-108) Bob Saint Clar (FR) Shizhao (Zh-Hans) Wiki Lic (ES) Agung Karjono (ID) Szaszicie (HU).png par sponk (cc par 3.0) via Commons Wikimedia


