Différence entre la constante ebullioscopique et la constante cryoscopique
Le différence clé entre la constante d'ébullioscopie et la constante cryoscopique est que La constante d'ébullioscopie est liée à l'élévation du point d'ébullition d'une substance tandis que la constante cryoscopique est liée à la dépression de point de congélation d'une substance.
La constante d'ébullioscopie et la constante cryoscopique sont des termes utilisés principalement dans la thermodynamique pour décrire les propriétés d'une substance par rapport aux changements de température. Ces deux constantes donnent la même valeur pour une substance particulière dans des conditions similaires via différentes routes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la constante ebullioscopique
3. Qu'est-ce que la constante cryoscopique
4. Comparaison côte à côte - constante d'ébullioscopie vs constante cryoscopique sous forme tabulaire
5. Résumé
Qu'est-ce que la constante ebullioscopique?
Une constante ebullioscopique est un terme thermodynamique qui relie la molalité d'une substance à son élévation du point d'ébullition. Nous pouvons désigner une constante ebullioscopique comme KB, élévation du point d'ébullition comme ΔT et molalité comme «B». La constante est donnée comme le rapport entre l'élévation du point d'ébullition et la molalité (élévation du point d'ébullition divisé par la moalité est égale à constante d'ébullioscopie, kb). Nous pouvons donner l'expression mathématique de cette constante comme suit:
Δt = ikbb
Dans cette équation, «I» est le facteur Van't Hoff. Il donne le nombre de particules que le soluté peut se diviser ou se forme lorsque la substance est dissoute dans un solvant. «B» est la molialité de la solution formée après cette dissolution. En plus de cette équation simple, nous pouvons utiliser une autre expression mathématique pour calculer théoriquement la constante ebullioscopique:
Kb = RT2bM / Δhvapeur
Dans cette équation, R fait référence à la constante de gaz idéale (ou universelle), la tuberculose se réfère au point d'ébullition du solvant, M fait référence à la masse molaire du solvant et ΔHvapeur fait référence à l'enthalpie molaire de la vaporisation. Cependant, dans le calcul de la masse molaire d'une substance, nous pouvons utiliser une valeur connue pour cette constante en utilisant une procédure appelée ebullioscopie. L'ébullioscopie fait référence à la «mesure d'ébullition» en sens latin.

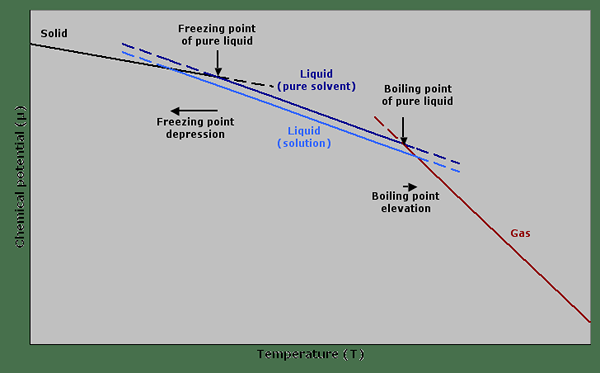
Figure 01: Dépression de point de congélation et élévation du point d'ébullition dans un graphique
La propriété d'élévation du point d'ébullition est considérée comme une propriété colligative où la propriété dépend du nombre de particules dissoutes dans le solvant et non la nature de ces particules. Certaines valeurs connues pour la constante d'ébullioscopie comprennent l'acide acétique ayant 3.08, le benzène ayant 2.53, camphre ayant 5.95, et disulfure de carbone ayant 2.34.
Qu'est-ce que la constante cryoscopique?
Une constante cryoscopique est un terme thermodynamique qui relie la molalité d'une substance à la dépression de point de congélation. La dépression de point de congélation est également une propriété colligative des substances. La constante cryoscopique peut être donnée comme ci-dessous:
ΔtF = IKFb
Ici, «I» est le facteur Van't Hoff, qui est le nombre de particules que le soluté peut se diviser ou se former lorsqu'il est dissous dans un solvant. La cryoscopie est le processus que nous pouvons utiliser pour déterminer la constante cryoscopique d'une substance. Nous pouvons utiliser une constante connue pour calculer une masse molaire inconnue. Le terme cryoscopie vient du sens grec, «mesure de congélation».
Étant donné que la dépression de point de congélation est une propriété colligative, elle ne dépend que du nombre de particules de soluté qui sont dissoutes et non de la nature de ces particules. Par conséquent, nous pouvons dire que la cryoscopie est liée à l'ébullioscopie. L'expression mathématique de cette constante est la suivante:
Kb = RT2FM / Δhfus
Où r est la constante de gaz idéale, m est la masse molaire du solvant, tF est le point de congélation du solvant pur et ΔHfus est l'enthalpie molaire de la fusion du solvant.
Quelle est la différence entre la constante d'ébullioscopie et la constante cryoscopique?
Constante ebullioscopique et constante cryoscopique sont des termes utilisés dans la thermodynamique. La principale différence entre la constante ebullioscopique et la constante cryoscopique est que la constante d'ébullioscopie est liée à l'élévation du point d'ébullition d'une substance tandis que la constante cryoscopique est liée à la dépression de point de congélation d'une substance.
En dessous de l'infographie résume les différences entre la constante d'ébullioscopie et la constante cryoscopique.

Résumé - constante ebullioscopique vs constante cryoscopique
La principale différence entre la constante ebullioscopique et la constante cryoscopique est que la constante d'ébullioscopie est liée à l'élévation du point d'ébullition d'une substance tandis que la constante cryoscopique est liée à la dépression de point de congélation d'une substance.
Référence:
1. «Constante cryoscopique.»Wikipedia, Wikimedia Foundation, 4 février. 2020, disponible ici.
Image gracieuseté:
1. «Élévation de la dépression du point de congélation et du point d'ébullition» - Freezing_Point_Point_Depression de modification.png par tomas er (cc by-sa 3.0) via Commons Wikimedia


