Différence entre la disproportionnement et redox

Le différence clé entre la disproportionnement et le redox est que Dans les réactions de disproportionnement, le même réactif subit une oxydation et une réduction. Mais, dans les réactions redox, deux réactifs différents subissent généralement une oxydation et une réduction.
En outre, la disproportionnement est une réaction chimique où une molécule est transformée en deux produits différents ou plus tandis que la réaction redox est un type de réaction chimique dans laquelle l'oxydation et la réduction se produisent simultanément. Par-dessus tout, la disproportionnement est un type de réaction redox car il y a deux réactions d'oxydation et de réduction simultanées.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la disproportionnement
3. Qu'est-ce que Redox
4. Comparaison côte à côte - disproportionnement vs redox sous forme tabulaire
5. Résumé
Qu'est-ce que la disproportionnement?
La disproportionnement est une réaction chimique où une molécule est transformée en deux produits différents ou plus. Fondamentalement, c'est un type de réaction redox où la même molécule subit à la fois l'oxydation et la réduction. De plus, l'inverse de cette réaction est appelé comproportionnement. La forme générale de ces réactions est la suivante:
2a ⟶ a '+ a "
De plus, certains exemples courants pour ce type de réactions sont les suivants
- Conversion du peroxyde d'hydrogène en eau et oxygène
2h2O2 ⟶ H2O + O2
- Disproportionnement du mercure (i) chlorure
HG2CL2 → Hg + HGCL2
- Disproportionnement de l'acide phosphorique dans l'acide phosphorique et la phosphine
4 h3Pote3 → 3 h3Pote4 + PH3
- La disproportionnement du fluorure de brome donne un trifluoride de brome et du brome
3 BRF → BRF3 + BR2
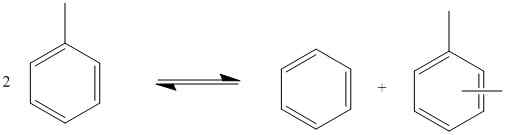
Figure 01: disproportionnée du toluène
Qu'est-ce que Redox?
La réaction redox est un type de réaction chimique dans laquelle l'oxydation et la réduction des demi-réactions se produisent simultanément. De plus, dans cette réaction, nous considérons l'oxydation et la réduction comme des processus complémentaires. Ici, l'oxydation est la perte d'électrons ou l'augmentation de l'état d'oxydation tandis que la réduction est le gain d'électrons ou la diminution de l'état d'oxydation.

Figure 02: rouille
De plus, la vitesse d'une réaction redox peut varier de processus très lents tels que la rouille à des processus rapides tels que la combustion de carburant.
Quelle est la différence entre la disproportion et Redox?
La principale différence entre la disproportion et le redox est que dans les réactions de disproportionnement, le même réactif subit l'oxydation et la réduction, tandis que dans les réactions redox, deux réactifs différents subissent généralement l'oxydation et la réduction. Compte tenu de quelques exemples, la disproportionnement comprend la disproportionnement du chlorure de mercure (i) pour former du mercure et du mercure (ii) du chlorure, la disproportionnement du fluorure de brome pour former du trifluoride et du brome, etc. tandis que la rouille, la combustion, la combustion du carburant, etc. sont des exemples de réactions redox.
L'infographie ci-dessous résume la différence entre la disproportionnement et Redox.

Résumé - disproportionnement vs redox
La disproportionnement est une réaction chimique où une molécule est transformée en deux produits différents ou plus tandis que la réaction redox est un type de réaction chimique dans laquelle l'oxydation et la réduction se produisent simultanément. La principale différence entre la disproportion et le redox est que dans les réactions de disproportionnement, le même réactif subit l'oxydation et la réduction, alors que dans les réactions redox, généralement, deux réactifs différents subissent une oxydation et une réduction.
Référence:
1. Helmenstine, Anne Marie. «Définition de disproportionnement en chimie."Thoughtco, août. 6, 2019, disponible ici.
Image gracieuseté:
1. «Disproportionation of Toluene» par Warrenjlange - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Vis de rouille» par l'utilisateur: Paulnasca - propre travail (CC par 2.0) via Commons Wikimedia


