Différence entre la dimanot et la disproportionnement
Le différence clé entre la dimanutation et la disproportionnement est que La dimanot est le terme équivalent pour nommer une disproportionnement dans les systèmes biologiques tandis que la disproportionnement est une réaction redox dans laquelle les réactions d'oxydation et de réduction ont lieu dans le même réactif.
Une réaction redox est une forme de réaction chimique dans laquelle les états d'oxydation des atomes dans les molécules changent pendant la progression de la réaction. De plus, ce type de réactions a deux demi-réactions parallèles; réaction d'oxydation et réaction de réduction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la disciptialité
3. Qu'est-ce que la disproportionnement
4. Comparaison côte à côte - Dismutation vs disproportionation sous forme tabulaire
5. Résumé
Qu'est-ce que la disciptialité?
La dimanot est la disproportionnement qui se déroule dans les systèmes biologiques. Par conséquent, la dimanutation et la disproportionnement sont égales dans leurs processus, seule l'application du terme est différente.

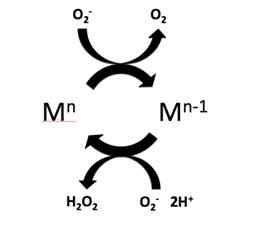
Figure 01: Le mécanisme de la disamatie (dissuffisance du radical libre superoxyde)
Par exemple, dans le cycle d'acide citrique de certaines bactéries, l'acide pyruvique se transforme en acide lactique, acide acétique et dioxyde de carbone. Cette réaction est également connue sous le nom Dismutation anaérobie.
Qu'est-ce que la disproportionnement?
La disproportionnement est une réaction redox dans laquelle les réactions d'oxydation et de réduction ont lieu dans le même réactif. Dans une réaction redox, les états d'oxydation des atomes dans les réactifs changent. Par conséquent, dans la disproportionnement, l'état d'oxydation d'un atome d'une molécule de réactif augmente tandis que l'état d'oxydation d'un atome de la même molécule de réactif diminue en même temps. Et aussi pour que la disproportion se produise, il devrait y avoir une espèce chimique avec un état d'oxydation intermédiaire.
2A → A+ + UN-
Exemples
Certains exemples courants de disproportionnement sont donnés ci-dessous.
- Disproportionnement du chlorure mercureur dans le mercure et le chlorure mercurique.
HG2CL2 → Hg + HGCL2
- Disproportionnement de l'acide phosphoreux dans l'acide phosphorique et la phosphine.
4h3Pote3→ 3H3Pote4 + PH3
- Disproportionnement de l'anion bicarbonate.
2hco3-→ CO32- + H2CO3
- Disproportionnement du dioxyde d'azote dans l'acide nitrique et l'acide nitreux lorsqu'il a réagi avec l'eau.
2No2 + H2O → HNO3 + HNO2
Quelle est la différence entre la dimanot et la disproportionnement?
Dismutation vs disproportionnement | |
| La dimanot est une disproportionnement qui se déroule dans les systèmes biologiques. | La disproportionnement est une réaction redox dans laquelle les réactions d'oxydation et de réduction ont lieu dans le même réactif. |
| Application | |
| Le terme dissuffisance fait référence à la disproportionnement qui se déroule dans les systèmes biologiques. | La disproportionnement est le terme équivalent dans les systèmes chimiques. |
Résumé - Dismutation vs disproportionnement
Les termes dissuffisance et disproportionment décrivent le même processus chimique. Cependant, seule l'application du terme est différente. La différence entre la divimutation et la disproportionnement est que la dimanot est le terme de nommer la disproportion qui se produit dans les systèmes biologiques tandis que la disproportionnement est une réaction redox dans laquelle les réactions d'oxydation et de réduction ont lieu dans le même réactif.
Référence:
1. «Définition médicale de la divigne.”Merriam-Webster, Merriam-Webster. Disponible ici
2. «Dismutation.”Dismutation - Wiktionary. Disponible ici
3. «Disproportionation.»Wikipedia, Wikimedia Foundation, 4 avril. 2018. Disponible ici
4. «Redox.»Wikipedia, Wikimedia Foundation, 14 avril. 2018. Disponible ici
Image gracieuseté:
1.«Mécanisme de réaction de la disamatie» par tinisanelement - propre travail, (cc by-sa 4.0) via Commons Wikimedia


