Différence entre la délocalisation et la résonance
Le différence clé entre la délocalisation et la résonance est que La délocalisation se réfère à la distribution d'électrons dans toute la zone d'une molécule plutôt qu'à attacher à une seule molécule tandis que la résonance se réfère à la stabilisation d'une molécule due à la délocalisation des électrons.
La délocalisation et la résonance sont des concepts chimiques liés; L'effet de résonance est expliqué en utilisant la délocalisation électronique des composés chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la délocalisation
3. Qu'est-ce que la résonance
4. Comparaison côte à côte - Delocalisation vs résonance sous forme tabulaire
5. Résumé
Qu'est-ce que la délocalisation?
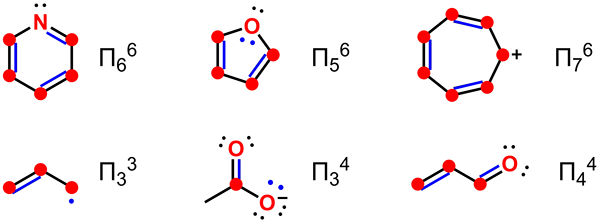
La délocalisation est un terme qui fait référence à la distribution d'électrons Pi sans liaison à travers une molécule. Par conséquent, nous pouvons décrire les électrons délocalisés comme les électrons sans liaison dans ce composé chimique. Le terme délocalisation se réfère aux électrons qui ne sont pas associés à un seul atome ou à une liaison covalente. Néanmoins, le terme électron délocalisé a des significations différentes dans différents champs. Par exemple, en chimie organique, les électrons délocalisés sont dans les structures de résonance des systèmes conjugués dans des composés aromatiques. De même, en physique à l'état solide, les électrons délocalisés sont les électrons libres qui facilitent la conduction électrique. De plus, la physique quantique utilise le terme électrons délocalisés pour désigner les électrons orbitaux moléculaires qui se sont étendus sur plusieurs atomes.

Figure 01: Délocalisation des électrons dans les molécules
L'exemple le plus simple que nous pouvons donner pour un système aromatique ayant des électrons délocalisés est l'anneau de benzène. L'anneau de benzène a six électrons Pi dans la molécule de benzène; Nous les indiquons souvent en utilisant graphiquement un cercle. Ce cercle signifie que les électrons Pi sont associés à tous les atomes de la molécule. Cette délocalisation fait que l'anneau de benzène a des liaisons chimiques avec des longueurs de liaison similaires.
Qu'est-ce que la résonance?
La résonance est un concept en chimie qui décrit l'interaction entre les paires d'électrons solitaires et les paires d'électrons de liaison d'un composé. L'effet de résonance aide à déterminer la structure chimique réelle de ce composé organique ou inorganique. Cet effet apparaît dans des composés ayant des liaisons doubles et des paires d'électrons solitaires. De plus, cet effet provoque la polarité des molécules.
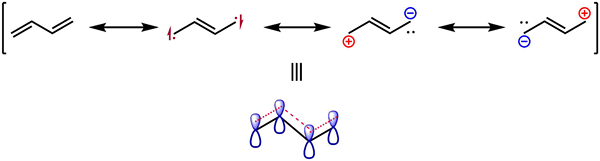
Figure 02: Structures de résonance de Butadiène
L'effet de résonance montre la stabilisation d'un composé chimique via la délocalisation des électrons dans les liaisons PI. Généralement, les électrons dans les molécules peuvent se déplacer autour des noyaux atomiques car un électron n'a pas de position fixe à l'intérieur des atomes. Par conséquent, les paires d'électrons solitaires sont capables de passer à des liaisons PI et vice versa. Cela se produit pour obtenir un état stable. Ce processus de mouvement d'électrons est connu sous le nom de résonance. De plus, nous pouvons utiliser des structures de résonance afin d'obtenir la structure la plus stable d'une molécule.
Une molécule peut avoir plusieurs structures de résonance basées sur le nombre de paires solitaires et de liaisons Pi présente dans cette molécule. Toutes les structures de résonance d'une molécule ont le même nombre d'électrons et le même arrangement d'atomes. La structure réelle de cette molécule est une structure hybride dans toutes les structures de résonance. Il existe deux types d'effet de résonance: l'effet de résonance positive et l'effet de résonance négatif.
L'effet de résonance positive explique la résonance qui peut être trouvée dans les composés ayant une charge positive. L'effet de résonance positive aide à stabiliser la charge positive dans cette molécule. L'effet de résonance négative explique la stabilisation d'une charge négative dans une molécule. Cependant, la structure hybride obtenue compte tenu de la résonance a une énergie plus faible que toutes les structures de résonance.
Quelle est la différence entre la délocalisation et la résonance?
La délocalisation et la résonance sont deux concepts chimiques apparentés. La principale différence entre la délocalisation et la résonance est que la délocalisation se réfère à la distribution des électrons dans toute la zone d'une molécule plutôt qu'à une seule molécule tandis que la résonance se réfère à la stabilisation d'une molécule due à la délocalisation des électrons.
De plus, la délocalisation se produit dans des molécules ayant d'autres liaisons uniques et doubles liais.
L'infographie ci-dessous résume les différences entre la délocalisation et la résonance.
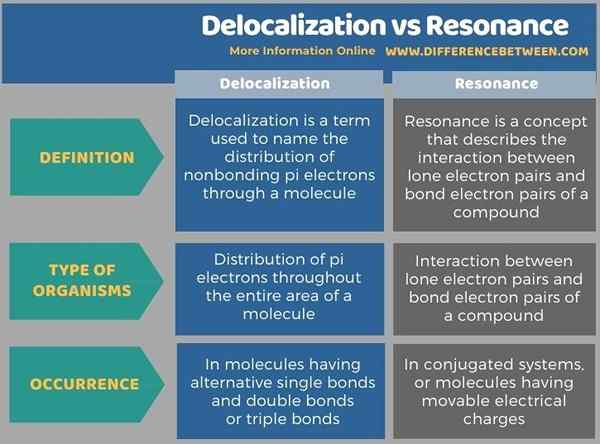
Résumé - Délocalisation vs résonance
La délocalisation et la résonance sont des concepts chimiques liés; L'effet de résonance est expliqué en utilisant la délocalisation électronique des composés chimiques. La principale différence entre la délocalisation et la résonance est que la délocalisation se réfère à la distribution des électrons dans toute la zone d'une molécule plutôt qu'à une seule molécule tandis que la résonance se réfère à la stabilisation d'une molécule due à la délocalisation des électrons.
Référence:
1. «Delocalisation des électrons.”LiBeTexts. Disponible ici.
Image gracieuseté:
1. «Delocalisation-mise à jour» par ALSOSAID1987 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Butadiène-Resonance» par ALSOSAID1987 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


