Différence entre la déshydratation par H2SO4 et H3PO4
Le différence clé entre la déshydratation par H2SO4 et H3PO4 La déshydratation par H2SO4 est moins sûre et facilite une réaction complexe, tandis que la déshydratation par H3PO4 est plus sûre et facilite une réaction moins complexe.
La déshydratation est essentiellement l'élimination de H2O. La déshydratation de l'éthanol et d'autres alcools peut être effectuée en utilisant deux catalyseurs d'acide différents: l'acide sulfurique (H2SO4) et l'acide phosphorique (V) (H3PO4). Dans ce processus, l'éthanol est déshydraté pour obtenir un produit alcène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la déshydratation par H2SO4
3. Qu'est-ce que la déshydratation par H3PO4
4. Comparaison côte à côte - déshydratation par H2SO4 vs H3PO4 sous forme tabulaire
5. Résumé
Qu'est-ce que la déshydratation par H2SO4?
La déshydratation par H2SO4 est un processus chimique qui est utile pour former des alcènes d'alcools à l'aide d'acide sulfurique comme catalyseur acide. Par conséquent, cette réaction comprend la formation d'un composé insaturé à partir d'un composé saturé. En d'autres termes, les réactifs de cette réaction n'ont que des liaisons simples, tandis que les produits de cette réaction ont des liaisons simples et doubles.
L'acide sulfurique est un catalyseur acide pour la déshydratation des alcools. Dans ce processus, nous devons utiliser l'acide sulfurique concentré. Cependant, l'utilisation de ce catalyseur acide donne des résultats quelque peu désordonnés. C'est parce que l'acide sulfurique est un agent oxydant très fort, et il peut réduire certains des alcools pour donner du dioxyde de gaz et se réduire pour produire du dioxyde de soufre. Par conséquent, ces deux gaz se produisent sous forme de contaminants dans le produit final et doivent être retirés. De plus, il y a également d'autres réactions; Par exemple, l'acide sulfurique réagit avec l'alcool pour donner une masse de carbone.
Dans le processus de déshydratation, l'alcool est chauffé avec de l'acide sulfurique à l'état concentré. Ici, une quantité excessive d'acide sulfurique doit être utilisée afin de s'assurer que tous les alcools réagissent avec l'acide. Une solution d'hydroxyde de sodium peut être utilisée pour éliminer les gaz indésirables produits dans cette réaction.
Qu'est-ce que la déshydratation par H3PO4?
La déshydratation par H3PO4 est un processus chimique qui est utile pour former des alcènes à partir d'alcools utilisant l'acide phosphorique (V) comme catalyseur acide. Par conséquent, cette réaction comprend la formation d'un composé insaturé à partir d'un composé saturé. En d'autres termes, les réactifs de cette réaction n'ont que des liaisons simples, tandis que les produits de cette réaction ont des liaisons simples et doubles.
Figure 02: réaction de déshydratation
Semblable à la méthode ci-dessus, cette méthode nécessite également le catalyseur acide dans son état concentré. Nous devons également utiliser une quantité excessive d'acide phosphorique (V) afin de nous assurer que toutes les molécules d'alcool sont réagies avec le catalyseur acide pour donner l'alcène souhaité. De plus, la déshydratation utilisant de l'acide phosphorique est principalement utilisée dans la production d'alcènes d'état liquide. Le principal avantage de cette réaction sur la déshydratation par l'acide sulfurique est que cette réaction ne donne pas de résultats désordonnés et qu'il est relativement sûr (aucun produit nocif n'est produit, e.g. dioxyde de soufre produit lors de l'utilisation de l'acide sulfurique car le catalyseur acide est un produit nocif).
Quelle est la différence entre la déshydratation par H2SO4 et H3PO4?
La déshydratation par H2SO4 est un processus chimique qui est utile pour former des alcènes d'alcools à l'aide d'acide sulfurique comme catalyseur acide. La déshydratation par H3PO4 est un processus chimique qui est utile pour former des alcènes à partir d'alcools utilisant l'acide phosphorique (V) comme catalyseur acide. La principale différence entre la déshydratation par H2SO4 et H3PO4 est que la déshydratation par H2SO4 est moins sûre et facilite une réaction complexe, tandis que la déshydratation par H3PO4 est plus sûre et facilite une réaction moins complexe.
Ci-dessous, l'infographie tabule plus de comparaisons pour discerner la différence entre la déshydratation par H2SO4 et H3PO4.

Résumé - Déshydratation par H2SO4 vs H3PO4
La déshydratation de l'éthanol et d'autres alcools peut être effectuée en utilisant deux catalyseurs acides différents; acide sulfurique et acide phosphorique (V). La principale différence entre la déshydratation par H2SO4 et H3PO4 est que la déshydratation par H2SO4 est moins sûre et facilite une réaction complexe, tandis que la déshydratation par H3PO4 est plus sûre et facilite une réaction moins complexe.
Image gracieuseté:
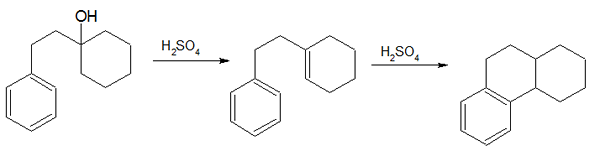
1. «Bogert-Cook Synthesis» par Mephisto Spa - propre travail (domaine public) via Commons Wikimedia
2. «Dianhydride éthylènetétracarboxylique via la déshydratation acide» par Dmacks (talk) - propre travail (domaine public) via Commons Wikimedia


