Différence entre l'acide conjugué et la base conjuguée
Le différence clé entre l'acide conjugué et la base conjuguée est que Les acides conjugués donnent des protons, tandis que les bases conjuguées acceptent les protons.
En 1923, deux scientifiques, Bronsted et Lowry ont présenté une théorie sur le comportement acide-base. Selon Bronsted - Lowry Theory, un acide est un donneur de protons, et une base est un accepteur de protons. Par conséquent, une molécule pour se comporter comme un acide devrait rencontrer un accepteur de protons. D'un autre côté, une molécule pour se comporter comme une base, elle devrait rencontrer un donneur de protons. Par conséquent, pour une réaction acide-base, les donneurs de protons et les accepteurs devraient être là. Cependant, l'eau peut agir à la fois comme l'acide et la base. Lorsque l'eau accepte un proton, il forme un ion hydronium, et lorsqu'il donne un proton, il produit un ion hydroxyde.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide conjugué
3. Qu'est-ce que la base conjuguée
4. Comparaison côte à côte - acide conjugué vs base conjuguée sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide conjugué?
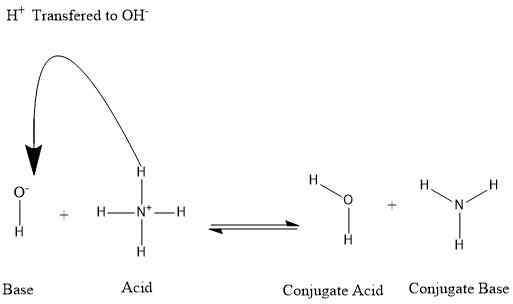
L'acide conjugué est une substance fabriquée à partir d'une base. Lorsqu'une base accepte un proton d'une autre molécule, il forme un acide conjugué. L'acide conjugué peut éliminer l'électron et retourner à la base parentale. Ainsi, les acides conjugués ont des propriétés acides.

Figure 01: Formation d'acide conjugué et de base conjuguée
Par exemple, nous pouvons considérer la situation où l'ammoniac se dissout dans l'eau.
NH3+ H2O ⇌ NH4+ + OH-
Dans l'exemple ci-dessus, l'ion d'ammonium est l'acide conjugué de l'ammoniac. De même, lorsque l'on considère la réaction vers l'arrière, l'eau est l'acide conjugué de la base d'hydroxyde.
Qu'est-ce que la base conjuguée?
La base conjuguée est une substance qui se forme après qu'un acide abandonne un proton à une base. Mais cela peut à nouveau accepter un proton; Ainsi, il a des caractéristiques de base. L'accepteur de proton potentiel formé à partir de l'acide parent est la base conjuguée. Lorsque la base conjuguée accepte un proton, il est à nouveau inversé à l'acide parent.
En outre, de nombreux solvants peuvent agir en tant que donateurs de protons ou accepteurs. Par conséquent, ils peuvent induire le comportement acide ou de base en solutés. Par exemple, lorsque l'ammoniac se dissout dans l'eau, l'eau agit comme l'acide et donne un proton à l'ammoniac, et donc, formant un ion d'ammonium. Pendant ce temps, la molécule d'eau est convertie en un anion hydroxyde. Ici, la base conjuguée de l'eau est l'anion hydroxyde. Et la base conjuguée de l'ammonium est l'ammoniac.
Quelle est la différence entre l'acide conjugué et la base conjuguée?
La principale différence entre l'acide conjugué et la base conjuguée est que les acides conjugués peuvent donner des protons, tandis que les bases conjuguées peuvent accepter les protons. De plus, les acides conjugués sont formés à partir de bases; Inversement, les bases conjuguées sont formées à partir d'acides. Cependant, les acides et les bases conjugués qui se forment dans une réaction spontanée sont beaucoup plus faibles que leurs molécules parentales.

Résumé - Acide conjugué vs base conjuguée
L'acide conjugué et la base conjuguée sont une paire d'espèces chimiques qui ont un comportement chimique opposé. La principale différence entre l'acide conjugué et la base conjuguée est que les acides conjugués peuvent donner des protons, tandis que les bases conjuguées peuvent accepter les protons.
Référence:
1. LibreTexts. «11.12: paires de bases de base conjuguées.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Réaction de base conjuguée» par Schlenk (CC BY-SA 3.0) via Commons Wikimedia


