Différence entre la composition et la stoechiométrie de réaction
Le différence clé entre la composition et la stoechiométrie de réaction est que Composition La stoechiométrie fait référence à la composition atomique d'un composé chimique, tandis que la stoechiométrie de réaction fait référence à la quantité de composés consommés ou produits lors d'une réaction chimique.
La stoechiométrie est un terme chimique qui décrit les données quantitatives sur un composé chimique ou une réaction chimique. Si ces données concernent un composé chimique, nous l'appelons stoechiométrie de composition; S'il s'agit d'une réaction chimique, nous pouvons l'appeler stoechiométrie de réaction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la stoechiométrie de la composition
3. Qu'est-ce que la stoechiométrie de réaction
4. Comparaison côte à côte - Composition vs stoechiométrie de réaction sous forme tabulaire
5. Résumé
Qu'est-ce que la stoechiométrie de la composition?
La stoechiométrie de composition est l'analyse quantitative d'un composé chimique concernant sa composition atomique. Ce terme fait référence aux types d'atomes et à leur nombre présent dans un composé chimique particulier. Nous pouvons déterminer cela en utilisant la formule chimique du composé. L'atomicité d'une molécule donne le nombre total d'atomes présents dans un composé chimique. Mais il ne donne aucun détail sur les éléments chimiques auxquels appartiennent les atomes du composé et leurs chiffres. Néanmoins, nous pouvons utiliser la stoechiométrie de composition d'un composé particulier pour prédire la formule chimique. Par conséquent, la stoechiométrie de la composition est simplement la composition chimique d'une espèce chimique.
Par exemple, la stoechiométrie de composition de la molécule de glucose est donnée comme six atomes de carbone, douze atomes d'hydrogène et six atomes d'oxygène. Par conséquent, nous pouvons déterminer qu'une molécule de glucose contient du carbone, de l'hydrogène et des atomes d'oxygène dans le rapport de 6: 12: 6. C'est la stoechiométrie de la composition du glucose.
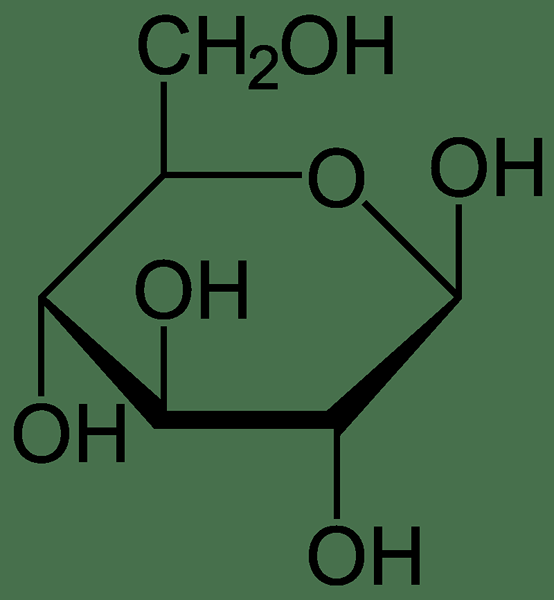
Figure 01: Composition chimique d'une molécule de glucose
Il existe différentes façons de déterminer la stoechiométrie de composition d'un composé inconnu. Des échantillons du composé inconnu peuvent être utilisés pour déterminer les types d'éléments chimiques dans cet échantillon avec la masse de chaque élément. Ensuite, le nombre de moles de chaque élément par échantillon peut être calculé à l'aide de ces masses. Les valeurs molaires peuvent être arrondies pour obtenir le rapport le plus possible entre les différents types d'atomes dans l'échantillon pour prédire la formule moléculaire.
Qu'est-ce que la stoechiométrie de réaction?
La stoechiométrie de réaction est le rapport entre les réactifs et les produits d'une certaine réaction chimique. Ce phénomène est très important pour équilibrer une réaction chimique pour obtenir la relation entre les réactifs et la quantité de produits que nous pouvons obtenir en réagissant ces espèces.

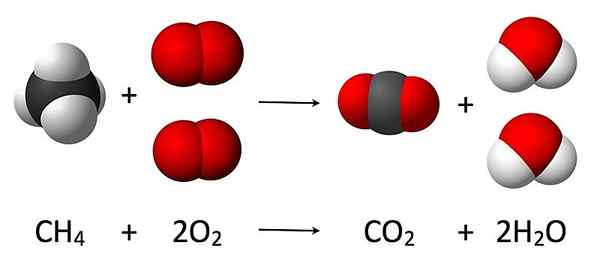
Figure 02: Un exemple pour une stoechiométrie de réaction
Le concept de stoechiométrie de réaction est basé sur la loi de la conservation de la masse, qui indique que la masse totale des réactifs doit être égale à la masse totale de produits car la masse ne peut pas être créée ou détruite, ne peut être convertie qu'en d'autres formes, tout comme l'énergie.
Considérons un exemple pour comprendre la théorie derrière la stoechiométrie de la réaction. La réaction entre un métal alcalin et l'eau produit de l'énergie thermique, de l'hydroxyde du métal et de l'hydrogène gazeux. Ici, les détails que nous connaissons sont la masse du métal alcalin utilisé et la quantité d'eau utilisée pour la réaction. Après la fin de la réaction, la quantité d'hydrogène gazeuse peut être collectée et en utilisant son volume, les moles d'hydrogène gazeuses peuvent être calculées. Par conséquent, en supposant que tout le métal alcali a réagi avec l'eau, nous pouvons obtenir le rapport entre les réactifs et les produits impliqués dans cette réaction. C'est la stoechiométrie de réaction du métal alcali dans la réaction de l'eau.
Quelle est la différence entre la composition et la stoechiométrie de réaction?
La principale différence entre la composition et la stoechiométrie de réaction est que la stoechiométrie de composition se réfère à la composition atomique d'un composé chimique, tandis que la stoechiométrie de réaction se réfère à la quantité de composés consommés ou produits lors d'une réaction chimique. Alors que la stoechiométrie de composition donne le rapport entre les atomes de chaque élément chimique présent dans un composé, la stoechiométrie de réaction donne le rapport entre les réactifs et les produits impliqués dans une réaction particulière.
En dessous de l'infographie résume la différence entre la composition et la stoechiométrie de réaction.

Résumé - Composition vs stoechiométrie de réaction
La stoechiométrie est une méthode d'analyse quantitative d'un composé chimique ou d'une réaction chimique. La principale différence entre la composition et la stoechiométrie de réaction est que la stoechiométrie de composition se réfère à la composition atomique d'un composé chimique, tandis que la stoechiométrie de réaction se réfère à la quantité de composés consommés ou produits lors d'une réaction chimique.
Référence:
1. «Stoechiométrie et réactions d'équilibrage." Chemistry LibreTexts, LibreTexts, 25 septembre. 2019, disponible ici.
Image gracieuseté:
1. «Beta-D-Glucopyranose» par Neurotiker - Propre travaux (domaine public) via Commons Wikimedia
2. «Réaction de combustion du méthane» par Jyntorobert A. Rohdejacek Fhjynto - (Domaine public) via Commons Wikimedia


