Différence entre l'oxyde de cobalt et le carbonate de cobalt

Le différence clé entre l'oxyde de cobalt et le carbonate de cobalt est que L'oxyde de cobalt apparaît comme une poudre noire, tandis que le carbonate de cobalt apparaît comme une poudre de violet rose.
L'oxyde de cobalt et le carbonate de cobalt sont des composés chimiques inorganiques. Ces deux composés ont des propriétés chimiques et physiques différentes. À première vue, ils apparaissent dans différentes couleurs, nous pouvons donc nommer l'apparence comme la principale différence entre eux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxyde de cobalt
3. Qu'est-ce que le carbonate de cobalt
4. Comparaison côte à côte - Oxyde de cobalt vs carbonate de cobalt sous forme tabulaire
5. Résumé
Qu'est-ce que l'oxyde de cobalt
Le monoxyde d'oxyde de cobalt (II) ou de cobalt est un composé inorganique ayant la formule chimique COO. Il apparaît comme une poudre noire. Cependant, nous pouvons parfois l'observer comme des cristaux vert olive ou des cristaux rouges. Ce composé est largement utilisé dans l'industrie de la céramique comme additif pour les émails. Il est également important dans l'industrie chimique pour la production de sels de cobalt (II).
Lorsque vous envisagez la structure et les propriétés de l'oxyde de cobalt (II), il obtient souvent la structure périclase, qui ressemble à la structure du sel rocheux. À très basses températures, ce composé est antiferromagnétique. De plus, ce composé est insoluble dans l'eau. Il peut réagir avec les acides minéraux pour former un composé de sel correspondant.
En outre, il existe différentes façons de produire de l'oxyde de cobalt (II). Par exemple, l'oxyde de cobalt (II, III) subit une décomposition à des températures très élevées et forme de l'oxyde de cobalt (ii). Pour la production d'oxyde de cobalt (II) disponible dans le commerce, nous pouvons effectuer un processus d'électrolyse en utilisant une solution de chlorure de cobalt (II). En plus de cela, nous pouvons produire de l'oxyde de cobalt (II) via la précipitation de l'hydroxyde suivie d'une déshydratation thermique.
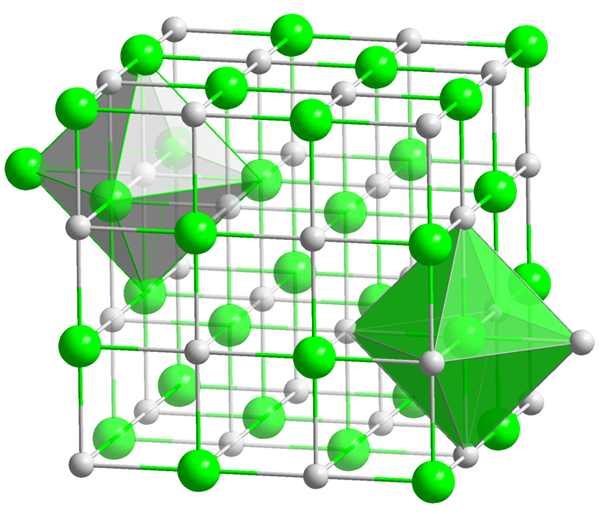
Figure 01: Structure d'oxyde de cobalt (ii)
De plus, il existe différentes applications d'oxyde de cobalt (II). Il est important comme agent de coloriage dans la production de poterie au four. Cet additif fournit au produit une couleur bleu profond nommé Cobalt Blue. Par conséquent, il est également utilisé dans la production de verre bleu cobalt.
Qu'est-ce que le carbonate de cobalt?
Carbonate de cobalt ou cobalt (ii) Le carbonate est un composé inorganique ayant la formule chimique coco3. C'est une poudre de violet rose qui ressemble à la couleur du permanganate. Nous pouvons préparer ce composé en combinant des solutions de sulfate de cobalt (II) et de bicarbonate de sodium. Le carbonate de cobalt a la structure de la calcite où les atomes de cobalt se trouvent dans une géométrie de coordination octaédrique.

Figure 02: Aspect du carbonate de cobalt
De plus, ce composé participe à différentes réactions chimiques en raison de la présence d'anion carbonate. Chauffage de ce carbonate donne des produits d'oxyde partiel avec un dioxyde de carbone. Le composé partiellement oxydé résultant se convertit ensuite réversible en oxyde de cobalt (II) à des températures élevées. Ce composé est également insoluble dans l'eau. Mais il est facilement attaqué par les acides minéraux.
Il existe plusieurs applications de carbonate de cobalt. C'est le précurseur de la production de carbonyle de cobalt et de nombreux autres sels de cobalt. C'est aussi un ingrédient dans les compléments alimentaires car le cobalt est un élément essentiel. De plus, c'est un précurseur de la glaçure en poterie bleue.
Quelle est la différence entre l'oxyde de cobalt et le carbonate de cobalt?
Le monoxyde d'oxyde de cobalt (II) ou de cobalt est un composé inorganique ayant la formule chimique COO tandis que le carbonate de cobalt ou le carbonate de cobalt (II) est un composé inorganique ayant la formule chimique CoCO3. La principale différence entre l'oxyde de cobalt et le carbonate de cobalt est que l'oxyde de cobalt apparaît comme une poudre noire, tandis que le carbonate de cobalt apparaît comme une poudre de violet rose.
Ci-dessous énumère plus de différences entre l'oxyde de cobalt et le carbonate de cobalt.

Résumé - Oxyde de cobalt vs carbonate de cobalt
L'oxyde de cobalt ou le cobalt (ii) l'oxyde et le cobalt (ii) le carbonate contiennent un ion métallique de cobalt avec un état d'oxydation +2. La principale différence entre l'oxyde de cobalt et le carbonate de cobalt est que l'oxyde de cobalt apparaît comme une poudre noire, tandis que le carbonate de cobalt apparaît comme une poudre de violet rose.
Référence:
1. Carbonate de cobalt (ii). (2020, 08 juin). Récupéré le 26 août 2020, de disponible ici.
Image gracieuseté:
1. «NaCl Polyhedra» par Solid State - Propre travaux (domaine public) via Commons Wikimedia
2. «Cobalt (2) Carbonate» par Roterham - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


