Différence entre l'agent chélatant et l'agent de séquestration
Différence clé - agent chélatant vs agent de séquestration
Les agents chélatants et les agents de séquestration éliminent les ions métalliques d'une solution en formant un complexe avec cet ion métallique particulier. Ce processus est appelé chélation. Il peut être utilisé pour éliminer la dureté de l'eau ou les métaux lourds de l'eau. De nombreux chélateurs et séquestrants ont des préférences en ions métalliques, ce qui signifie que le chélateur ou le séquestrant se liera avec un ion métallique particulier avant de se lier avec d'autres ions métalliques dans ce système. La principale différence entre l'agent chélatant et l'agent de séquestration est que Un agent chélatant peut se lier avec un seul ion métallique alors que Un agent de séquestration peut se lier avec peu d'ions métalliques à la fois.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un agent chélatant
3. Qu'est-ce qu'un agent de séquestration
4. Similitudes entre l'agent chélatant et l'agent de séquestration
5. Comparaison côte à côte - agent chélatant vs agent de séquestration sous forme tabulaire
6. Résumé
Qu'est-ce qu'un agent chélatant?
Un agent chélatant est une substance qui a la capacité de faire plusieurs liaisons avec un seul ion métallique et de former un complexe. L'ion métal ne peut participer à aucune autre réaction qui se produit dans le système en raison de la formation d'un complexe. C'est ce qu'on appelle la chélation. Si l'agent chélatant fait deux liaisons avec les ions métalliques, l'agent chélatant est appelé biderneter; S'il forme plus de liens, il s'appelle multinational.
L'agent chélatant forme des complexes solubles d'eau stables de métaux. Cela empêche le métal de participer à ses réactions normales. L'agent chélatant forme des liaisons de coordination avec l'ion métallique, modifiant la structure chimique de l'ion métallique. Les agents chélateurs sont très importants dans les réactions chimiques. Si une solution a un mélange de deux ions métalliques, nous pouvons ajouter un agent chélatant pour empêcher l'autre ion métallique d'interférer dans les réactions afin de trouver la quantité d'un ion métallique présent dans la solution. Les agents chélateurs sont des composés organiques naturels ou synthétiques utilisés dans les applications industrielles ou biologiques.
Un bon exemple d'agent chélatant est Éthylènediamine. Il peut former deux liaisons avec des ions de métal de transition tels que le nickel (II). L'ion nickel possède six électrons covalents; En d'autres termes, il a trois paires d'électrons. Ainsi, trois molécules d'éthylènediamine se lieront à un ion métallique.
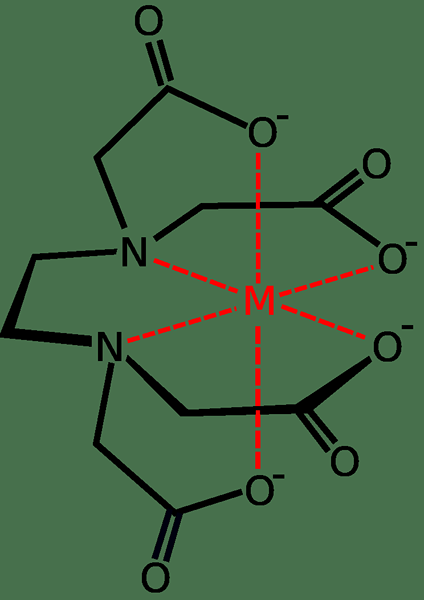
Un autre exemple courant est EDTA. Il est principalement utilisé dans les savons et les détergents car la molécule EDTA peut se lier aux ions de calcium et de magnésium dans l'eau dure, empêchant les interférences dans le processus de nettoyage des savons et des détergents.

Figure 01: liaison EDTA avec un seul ion métallique
Qu'est-ce qu'un agent de séquestration?
Les agents de séquestration sont des substances chimiques qui peuvent se lier aux ions métalliques dans une solution. La combinaison de l'agent de séquestration et des ions métalliques forme un complexe stable et soluble. Ensuite, cet ion métallique particulier ne peut pas subir d'autres réactions (réactions que l'ion métallique subit lorsqu'il n'y a pas d'agent de séquestration). Bien qu'il montre la même action qu'un agent chélatant, il diffère d'un agent chélatant par sa manière de «revêtement» un ion métallique; Les agents de séquestration sont composés de peu de sites actifs qui peuvent se lier avec des ions métalliques. Cela fait que l'agent de séquestration est plus puissant qu'un agent chélatant car un agent chélatant ne peut se lier qu'avec un seul ion métallique.
La plupart du temps, les ions métalliques ressemblent à un arrangement de chaîne. Ensuite, la liaison des agents de séquestration aux extrémités des chaînes forme une structure en forme de cycle qui peut facilement être retirée.
Quelles sont les similitudes entre l'agent chélatant et l'agent de séquestration?
- Les agents de séquestration sont également un type d'agent chélatant.
- Les agents chélateurs et séquestrés peuvent se lier aux ions métalliques dans une solution et peuvent empêcher l'ion métallique de subir ses réactions normales.
- Les agents chélatants et les agents de séquestration sont des composés organiques qui peuvent être naturels ou synthétiques.
- Les deux peuvent former des complexes stables et solubles avec des ions métalliques.
Quelle est la différence entre l'agent chélatant et l'agent de séquestration?
Agent chélatant vs agent de séquestration | |
| Les agents chélatants sont des composés chimiques qui peuvent se lier à un ion métallique dans une solution et l'empêcher de ses réactions normales. | Les agents de séquestration sont des composés chimiques qui peuvent se lier à plusieurs ions métalliques dans une solution et l'empêcher de ses réactions normales. |
| Nombre d'ions métalliques | |
| Les agents chélatants se lient avec un seul ion métallique à la fois. | Les agents de séquestration peuvent se lier avec plusieurs ions métalliques à la fois. |
| Sites actifs | |
| Les agents chélateurs ont un site actif par molécule. | Les agents de séquestration ont peu de sites actifs par molécule. |
| Potentiel | |
| Les agents chélateurs sont moins puissants en raison de la présence d'un seul site actif. | Les agents de séquestration sont plus puissants en raison de la présence de plusieurs sites actifs. |
| Formation de complexe | |
| Les agents chélatants forment des molécules complexes qui sont solubles dans l'eau. | Les agents de séquestration forment des structures en forme de cycle qui peuvent être retirées de la solution. |
Résumé - Agent chélatant vs agent de séquestration
Les agents chélatants et les agents de séquestration sont importants dans les applications industrielles, biologiques et médicales. Il est également utile pour se débarrasser de la dureté dans l'eau. Bien que les agents chélatants et les agents de séquestration fassent la même action dans un système, ce sont des termes différents. La principale différence entre l'agent chélatant et l'agent de séquestration est qu'un agent chélatant peut se lier avec un seul ion métallique alors qu'un agent de séquestration peut se lier avec peu d'ions métalliques à la fois.
Télécharger la version PDF de l'agent chélatant vs agent de séquestration
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre l'agent chélatant et l'agent de séquestration.
Les références:
1. Tony Hargreaves. «Agents chélatants, séquestrants.”Agents chélateurs, séquestrants | Ingénierie360. N.p., n.d. la toile. Disponible ici. 05 juin 2017.
2. Mazadul Hasan. «Agents de séquestration.”LinkedIn SlideShare. N.p., 22 mai 2014. la toile. Disponible ici. 05 juin 2017.
Image gracieuseté:
1. «Metal-edta» par Smokefootderivative Work: Chamberlain2007 (Talk) - Medta.PNG, domaine public) via Commons Wikimedia


