Différence entre la réduction carbothermique et métalothermique
Le différence clé entre la réduction carbothermique et métalothermique est que En réduction carbothermique, l'agent réducteur est du carbone, tandis que, en réduction métallothermique, l'agent réducteur est un métal.
La réduction carbothermique et la réduction métallothermique sont des réactions très importantes dans l'obtention du métal pur. Ces réactions sont appliquées principalement dans les processus industriels.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la réduction carbothermique
3. Qu'est-ce que la réduction métallothermique
4. Comparaison côte à côte - Réduction carbothermique vs métalothermique de la forme tabulaire
5. Résumé
Qu'est-ce que la réduction carbothermique?
La réaction de réduction carbothermique est un type de réaction chimique dans laquelle la réduction de substances telles que l'oxyde métallique se produit en présence de carbone. Ici, le carbone a tendance à agir en tant qu'agent réducteur. Habituellement, ce type de réactions chimiques se produit à des températures très élevées. Ces réactions de réduction carbothermique sont très importantes dans la production des formes élémentaires de nombreux éléments. Nous pouvons facilement prédire la capacité des métaux à participer à des réactions carbothermiques en utilisant des diagrammes Ellingham.
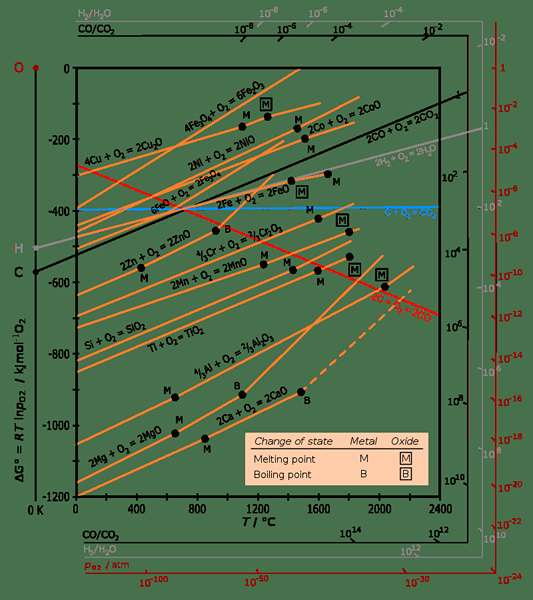
Le diagramme d'Ellingham est un graphique qui montre la dépendance à la température de la stabilité des composés. Généralement, cette analyse est utile pour élever la facilité de réduction des oxydes métalliques et des sulfures. Le nom vient de sa découverte par Harold Ellingham en 1944.

Figure 01: un diagramme d'Ellingham
Les réactions de réduction carbothermique sont capables de produire du monoxyde de carbone et même du dioxyde de carbone parfois. Nous pouvons décrire la conversion des réactifs en produits concernant le changement d'entropie. Dans cette réaction, deux composés solides (oxyde métallique et carbone) se convertissent en un nouveau composé solide (métal) et un gaz (monoxyde de carbone ou dioxyde de carbone). Cette dernière réaction a une entropie élevée.
Il existe de nombreuses applications de réactions de réduction carbothermique, notamment la fusion du minerai de fer comme application majeure. Ici, le minerai de fer est réduit en présence de carbone comme l'agent réducteur. Cette réaction donne du métal de fer et du dioxyde de carbone comme produits. Un autre exemple important est le processus de léblanc où le sulfate de sodium réagit avec le carbone, donnant du sulfure de sodium et du dioxyde de carbone.
Qu'est-ce que la réduction métallothermique?
La réaction de réduction métalothermique est un type de réaction chimique qui est effectuée pour obtenir un métal cible ou un alliage à partir de matériaux d'alimentation tels que des oxydes ou des chlorures en utilisant un métal comme agent réducteur. La plupart des métaux réactifs sont obtenus grâce à ce processus de réduction. E.g. titane métal.
Un exemple commun de ce type de réaction est la purification du niobium métal. Dans cette réaction de réduction, l'oxyde de niobium est réduit par l'aluminium pour donner du niobium métal et de l'oxyde d'aluminium. C'est une réaction exothermique où les scories d'oxyde d'oxyde de scories, et nous pouvons les retirer du niobium métalle fondu.
Quelle est la différence entre la réduction carbothermique et métallothermique?
La réduction carbothermique et la réduction métallothermique sont des réactions très importantes pour obtenir un métal pur. La réaction de réduction carbothermique est un type de réaction chimique dans laquelle la réduction de substances telles que l'oxyde métallique se produit en présence de carbone. Une réaction de réduction métalothermique, en revanche, est un type de réaction chimique qui est effectuée pour obtenir un métal cible ou un alliage de matériaux d'alimentation tels que les oxydes ou les chlorures en utilisant un métal comme agent réducteur. La principale différence entre la réduction carbothermique et métallothermique est que dans la réduction carbothermique, l'agent réducteur est le carbone alors qu'en réduction métalternative, l'agent réducteur est un métal.
L'infographie ci-dessous résume les différences entre la réduction carbothermique et métallothermique de la forme tabulaire.

Résumé - Réduction carbothermique vs métalothermique
La réduction carbothermique et la réduction métallothermique sont des réactions très importantes pour obtenir un métal pur. La principale différence entre la réduction carbothermique et métallothermique est que dans la réduction carbothermique, l'agent réducteur est du carbone, tandis que, en réduction métalothermique, l'agent réducteur est un métal.
Référence:
1. «Réduction métalothermique.”Science Direct, disponible ici.
Image gracieuseté:
1. «Ellingham Richardson-Diagram English» par Dersilberspiegel - auto-fabriqué avec la plupart des données d'ici [1] (CC BY-SA 4.0) via Commons Wikimedia


