Différence entre le carbocation et le carbanion
Carbocation vs Carbanion
Le différence clé Entre le carbocation et le carboanion se trouvent leurs charges; Ce sont tous deux des espèces moléculaires organiques avec des charges opposées. Le carbocation est un ion chargé positivement et le carboanion est un ion chargé négativement. Leur stabilité dépend de plusieurs facteurs, et certains d'entre eux sont très importants dans la synthèse d'autres composés chimiques.
Qu'est-ce que la carbocation
Un carbocation est une espèce chimique qui porte une charge positive sur un atome de carbone. Son nom donne l'idée claire que c'est un cation (un ion positif), et le mot carbo fait référence à un atome de carbone. La carbocation comprend plusieurs catégories; Carbocation primaire, carbocation secondaire et carbocation tertiaire. Ils sont classés en fonction du nombre de groupes alkyle attachés à l'atome de carbone chargé positivement. Leur stabilité et la réactivité varient en fonction de ces substituants.

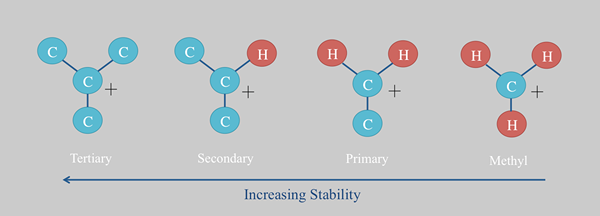
Tendance de stabilité des carbocations
Qu'est-ce que le carbanion
Un carboanion est une espèce moléculaire organique avec une charge électrique négative située sur un atome de carbone. En d'autres termes, c'est un anion dans lequel un atome de carbone possède une paire d'électrons non partagées avec trois substituants. Son nombre total d'électrons de valence est égal à huit. Ils sont formés en supprimant les groupes ou atomes chargés positivement d'une molécule neutre. Ils sont très importants en tant qu'intermédiaires chimiques pour synthétiser d'autres substances telles que les plastiques et le polyéthène (ou le polyéthylène). Le plus petit carbanoin est «ion méthide» (ch3-)); formé à partir de méthane (ch4) par la perte d'un proton (h-).

Quelle est la différence entre le carbocation et le carbanion?
Caractéristiques de la carbocation et du carbanion
Carbocation: La carbocation est SP2 hybridé, et la P-orbitale vacante se trouve perpendiculaire au plan de trois groupes substitués. Par conséquent, il a une structure moléculaire planaire trigonale. La carbocation nécessite une paire d'électrons pour compléter l'octet. Ils peuvent réagir avec les nucléophiles, peuvent être déprotonés à partir d'un Pi-Bond et peuvent avoir des réorganisations dans la même espèce.
Carbanion: Un carboanion alkyle a trois paires de liaisons et une paire seule; donc son hybridation est SP3, Et la géométrie est pyramidale. La géométrie de l'allyle ou du carboanion benzyl est planaire, et l'hybridation est SP2. L'octet est complet sur l'orbite la plus externe d'un atome de carbone gluanionique et se comporte comme un nucléophile pour réagir avec les électrophiles.
La stabilité:
Carbocation: La stabilité des carbocations dépend de divers facteurs. C'est plus stable lorsque davantage de groupes R sont attachés à l'atome de carbone positif. Par conséquent, le carbocation tertiaire est relativement stable que les primaires. 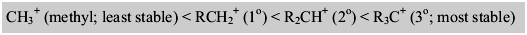 Les structures de résonance augmentent également la stabilité.
Les structures de résonance augmentent également la stabilité.
Carbanion: La stabilité du carboanion dépend de plusieurs facteurs; Électronégativité du carbone carbanionique, effet de résonance, effet inductif causé du substituant attaché et stabilisation par> C = C = O, -NO2 et les groupes CN présents sur le carbone carbanionique
Définitions:
Effet induit: il peut être un effet expérimentalement observable de la transmission de charge à travers une chaîne d'atomes dans une molécule, résultant en un dipôle permanent dans une liaison.
Exemples de carbocation et de carbanion
Carbocation:
Carbocation primaire: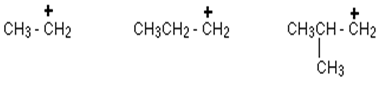
Dans un carbocation primaire (1 °), l'atome de carbone chargé positivement est attaché à un seul groupe alkyle et à deux atomes d'hydrogène.
Carbocation secondaire: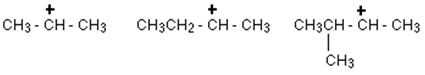
Dans un carbocation secondaire (2 °), l'atome de carbone chargé positivement est attaché à deux autres groupes alkyle (qui peuvent être identiques ou différents) et un atome d'hydrogène.
Carbocation tertiaire: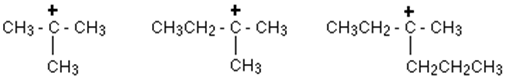
Dans un carbocation tertiaire (3 °), l'atome de carbone positif est attaché à trois groupes alkyle (qui peuvent être une combinaison de même ou de différente), mais pas d'atomes d'hydrogène.
Carbanion:
Le carboanion est également classé en trois catégories de la même manière que dans le carbocation; Carboanion primaire, carboanion secondaire et carboanion tertiaire. Cela se fait également sur la base du nombre de groupes -r attachés à l'atome de carbone anionique. 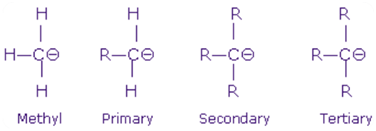
Les références:
«Carbocation." Wikipédia. Consulté le 09 juin 2016. d'ici «Carbocations (ou ions carbonium).»Chemguide. Consulté le 09 juin 2016. d'ici «Carbocations». Tutoriels de chimie des organismes. Consulté le 09 juin 2016. d'ici Image gracieuseté: «Tendance de stabilité des carbocations» par Alatleephillips - propre travail (CC BY-SA 4.0) via Commons Wikimedia «Carbanion Structural Formules V» par Jü - Own Work (CC0) via Commons Wikimedia

