Différence entre le chlorure de calcium et le chlorure de magnésium

Le différence clé entre le chlorure de calcium et le chlorure de magnésium est que Le chlorure de calcium contient un cation calcique avec deux anions de chlorure tandis que le chlorure de magnésium contient un cation de magnésium avec deux anions de chlorure.
Le chlorure de calcium et le chlorure de magnésium sont des composés de sel contenant des cations et des anions. Ce sont des solides à température ambiante qui sont très solubles dans l'eau. De plus, ces deux sont utilisés pour le contrôle de la poussière. Parlons de plus de détails à leur sujet.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorure de calcium
3. Qu'est-ce que le chlorure de magnésium
4. Comparaison côte à côte - chlorure de calcium vs chlorure de magnésium sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorure de calcium?
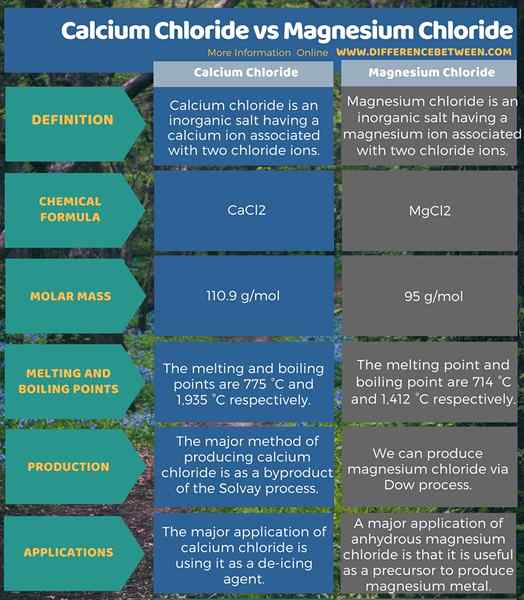
Le chlorure de calcium est un sel inorganique ayant un ion calcique associé à deux ions de chlorure. La formule chimique de ce composé est CaCl2. La masse molaire est 110.9 g / mol. À température ambiante, il existe comme un solide blanc cristallin. De plus, il est hygroscopique et se dissout facilement dans l'eau. Par conséquent, nous pouvons l'utiliser comme dessicant. Il est disponible sous forme de forme anhydre ou de formes hydratées. Les points de fusion et d'ébullition du chlorure de calcium anhydre sont respectivement de 775 ° C et 1 935 ° C. La principale méthode de production de chlorure de calcium est en tant que sous-produit du processus Solvay. Il utilise du calcaire.
2 NaCl + Caco3 → Na2CO3 + Cacl2
L'une des principales applications de ce composé est en tant qu'agent de désactivation. Il se dé-proice par le point de congélation déprimant de l'eau.

Figure 01: cristaux de chlorure de calcium
La deuxième plus grande application est qu'elle est utilisée comme agent de contrôle de la poussière. En raison de ses propriétés hygroscopiques, une solution concentrée peut garder une couche liquide sur la saleté de la surface d'une route. Par conséquent, il contrôle la poussière. De plus, il peut augmenter la dureté de l'eau. Ex: pour augmenter la dureté de l'eau dans les piscines.
Qu'est-ce que le chlorure de magnésium?
Le chlorure de magnésium est un sel inorganique ayant un ion de magnésium associé à deux ions de chlorure. La formule chimique de ce composé est mgcl2. La masse molaire est de 95 g / mol. Le point de fusion et les points d'ébullition sont respectivement de 714 ° C et 1412 ° C. À température ambiante, il existe comme un solide cristallin blanc ou incolore. Il est très soluble à l'eau et est également disponible sous des formes hydratées. Nous pouvons extraire la forme d'hydrate de la saumure ou de l'eau de mer. Il existe plusieurs hydrates de ce composé qui contiennent 2, 4, 6, 8 ou 12 molécules d'eau. Ces hydrates perdent ces molécules d'eau lors du chauffage. Nous pouvons produire ce composé via le processus Dow. Là, le chlorure de magnésium se régénère à partir de l'hydroxyde de magnésium lors de la réaction avec l'acide chlorhydrique.
Mg (oh)2(S) + 2 HCL → MGCL2 (aq) + 2 h2O(l)
Une application majeure du chlorure de magnésium anhydre est qu'il est utile comme précurseur pour produire du magnésium métal.

Figure 02: cristaux de chlorure de magnésium
Nous pouvons produire ce métal via l'électrolyse de MGCL2. De plus, nous pouvons utiliser ce composé pour le contrôle de la poussière, la stabilisation solide, l'atténuation de l'érosion éolienne, etc. Comme une autre importance, nous utilisons MGCL2 comme support de catalyseur pour le catalyseur Ziegler-Natta.
Quelle est la différence entre le chlorure de calcium et le chlorure de magnésium?
Le chlorure de calcium est un sel inorganique ayant un ion calcique associé à deux ions de chlorure. Par conséquent, la formule chimique de ce composé est CaCl2. Sa masse molaire est de 110.9 g / mol. De plus, les points de fusion et d'ébullition du chlorure de calcium anhydre sont respectivement de 775 ° C et 1 935 ° C. Le chlorure de magnésium est un sel inorganique ayant un ion de magnésium associé à deux ions de chlorure. Par conséquent, la formule chimique de ce composé est MGCL2. Sa masse molaire est de 95 g / mol. En plus de cela, le point de fusion et le point d'ébullition du chlorure de magnésium anhydre sont respectivement de 714 ° C et 1 412 ° C. Ces composés ont des applications différentes, mais une en commun; Tous deux sont des agents de contrôle de la poussière importants.
Résumé - chlorure de calcium vs chlorure de magnésium
Le chlorure de calcium et de magnésium est important en tant qu'agents de contrôle de la poussière. La différence entre le chlorure de calcium et le chlorure de magnésium est que le chlorure de calcium contient un cation calcique avec deux anions de chlorure alors que le chlorure de magnésium contient un cation de magnésium avec deux anions chlorure.
Référence:
1. "Chlorure de calcium.»Wikipedia, Wikimedia Foundation, 23 juillet 2018. Disponible ici
2. "Chlorure de magnesium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.'Chlorure de calcium cacl2'by Aucun auteur lisible par machine fourni. (CC BY-SA 3.0) via Commons Wikimedia
2.`` Chlorure de magnésium '' (domaine public) via les communes Wikimedia


