Différence entre le carbonate de calcium et le bicarbonate de calcium

Le différence clé entre le carbonate de calcium et le bicarbonate de calcium est que le La molécule de carbonate de calcium se compose d'éléments chimiques CA, C et O alors que le bicarbonate de calcium se compose d'éléments chimiques CA, C, O et H.
Le carbonate de calcium est un carbonate de calcium qui a la formule chimique Caco3. Il se produit naturellement et apparaît comme un solide blanc. Au contraire, le bicarbonate de calcium n'est pas solide, il existe uniquement comme une solution aqueuse. La formule chimique de ce composé est CA (HCO3)2.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbonate de calcium
3. Qu'est-ce que le bicarbonate de calcium
4. Comparaison côte à côte - carbonate de calcium vs bicarbonate de calcium sous forme tabulaire
5. Résumé
Qu'est-ce que le carbonate de calcium?
Le carbonate de calcium est un carbonate de calcium qui a la formule chimique Caco3. Ce composé se produit naturellement sous forme de calcaire, de craie, de calcite, etc. Par conséquent, c'est une substance commune dans les rochers. Ex: calcite ou aragonite (le calcaire contient ces deux formes). Ce composé se produit sous forme de cristaux hexagonaux blancs ou de poudre, et il est inodore.

Figure 01: cristaux de carbonate de calcium
De plus, il a un goût crayeux. La masse molaire de ce composé est de 100 g / mol et le point de fusion est de 1339 ° C (pour la forme de calcite). Cependant, il n'a pas de point d'ébullition car ce composé se décompose à des températures élevées. Nous pouvons obtenir ce composé en exploitant les minéraux porteurs de calcium. Mais cette forme n'est pas pure. Nous pouvons obtenir une forme pure en utilisant une source pure quee-caisse comme le marbre. Lorsque le carbonate de calcium réagit avec les acides, il forme du CO2 gaz. Quand il réagit avec l'eau, il forme de l'hydroxyde de calcium. De plus, il peut subir une décomposition thermique libérant du CO2 gaz.
Qu'est-ce que le bicarbonate de calcium?
Le bicarbonate de calcium est le carbonate de calcium ayant la formule chimique CA (HCO3)2. Il ne se produit pas comme un solide, n'existe que comme une solution aqueuse. Cette solution contient des ions calcium (CA2+), ions bicarbonate (HCO3-) et Cie32- avec un dioxyde de carbone dissous. Cependant, les concentrations de ces ions dépendent du pH du milieu, ce qui signifie que différents ions prédominent à différentes valeurs de pH.
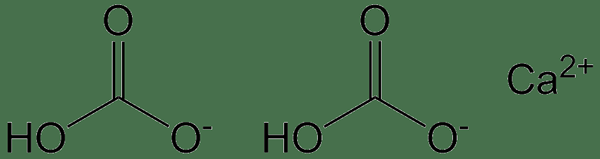
Figure 02: Structure chimique du bicarbonate de calcium
La masse molaire de ce composé est 162.11 g / mol. Ce composé se forme lorsque l'eau de pluie contenant du dioxyde de carbone dissous réagit avec le calcaire. Par conséquent, ce composé se lave avec l'eau de pluie.
Quelle est la différence entre le carbonate de calcium et le bicarbonate de calcium?
Le carbonate de calcium est un carbonate de calcium qui a la formule chimique Caco3. La masse molaire de ce composé est de 100 g / mol. De plus, ces molécules contiennent des éléments chimiques CA, C et O. Le bicarbonate de calcium est le carbonate de calcium ayant la formule chimique CA (HCO3)2. La masse molaire de ce composé est 162.11 g / mol. De plus, ces molécules contiennent des éléments chimiques CA, C, O et H.

Résumé - Carbonate de calcium vs bicarbonate de calcium
Le principal carbonate de calcium est le carbonate de calcium et le bicarbonate de calcium. La principale différence entre le carbonate de calcium et le bicarbonate de calcium est que la molécule de carbonate de calcium se compose d'éléments chimiques CA, C et O alors que le bicarbonate de calcium se compose d'éléments chimiques CA, C, O et H.
Référence:
1. "Carbonate de calcium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. «Bicarbonate de calcium.»Wikipedia, Wikimedia Foundation, 29 juin 2018. Disponible ici
Image gracieuseté:
1.'Calcium Carbonate Rocks'B Ferdous - Propre Travail, (CC BY-SA 3.0) via Commons Wikimedia
2.'Calcium Bicarbonate'By Epop - Propre travaux (domaine public) via Commons Wikimedia


