Différence entre le moment de la liaison et le moment dipolaire
Différence clé - Moment de liaison vs moment dipolaire
Les termes le moment de la liaison et le moment dipolaire sont basés sur des principes similaires mais sont différents en fonction de l'application. Le moment de la liaison est également connu sous le nom de moment de dipol de Bond. C'est la polarité d'une liaison chimique qui est située dans une certaine molécule. Le moment dipolaire, en revanche, est tout type de séparation électrique (séparation des charges). La principale différence entre le moment de la liaison et le moment dipolaire est que Le moment de liaison se produit dans une liaison chimique covalente tandis que le moment dipolaire se produit entre deux ions dans une liaison ionique ou entre deux atomes dans une liaison covalente.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le moment Bond
3. Qu'est-ce que le moment dipolaire
4. Similitudes entre le moment de la liaison et le moment dipolaire
5. Comparaison côte à côte - Moment de liaison vs moment dipolaire sous forme tabulaire
6. Résumé
Qu'est-ce que le moment Bond?
Le moment de la liaison est la séparation des charges électriques dans une liaison chimique covalente qui est présente dans un certain composé chimique. Par conséquent, cela donne la polarité d'une liaison chimique. Le moment de liaison se produit lorsqu'il y a une séparation positive et négative des charges dans une liaison chimique. Le moment dipolaire de liaison est indiqué par le symbole «μ».
μ = Δd
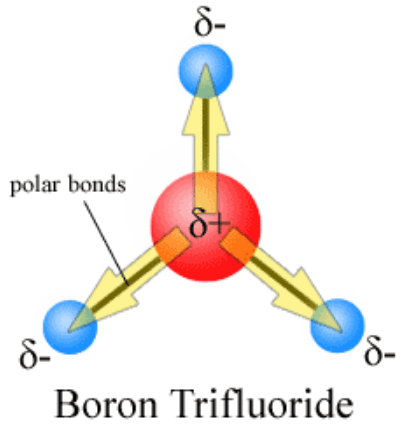
dans lequel, Δ est la valeur de charge et d est la distance entre deux atomes dans la liaison covalente. Dans la création d'un moment dipolaire de liaison, les charges électriques sont séparées en charges partielles Δ + et δ-. Cette séparation de charges se produit dans des liaisons chimiques lorsque deux atomes participant à la formation de liaisons ont des valeurs d'électronégativité différentes. Étant donné que l'électronégativité d'un atome est l'affinité pour les électrons, plus d'atomes électronégatifs attirent les électrons de liaison vers eux. Ensuite, l'atome avec une valeur moins électronégative obtient une charge positive partielle car la densité des électrons autour de cet atome est moindre. En conséquence, l'atome ayant une électronégativité élevée obtient une charge négative partielle.

Figure 1: Polarité du trifluorure de bore (BF3)
L'unité SI pour la mesure du moment dipolaire des liaisons est Coulomb-Meter (C M). Une molécule diatomique n'a qu'une seule liaison covalente. Par conséquent, le moment dipolaire de liaison d'une molécule diatomique est similaire au moment dipolaire moléculaire. Le moment dipolaire moléculaire pour les molécules diatomiques contenant deux atomes similaires est nulle, i.e., le moment dipolaire moléculaire de Cl2 est zéro. Mais des composés hautement ioniques tels que KBR ont un moment de liaison élevé et un moment moléculaire. Pour les molécules polyatomiques complexes, il existe de nombreuses liaisons covalentes. Ensuite, le moment dipolaire moléculaire est déterminé par tous les moments dipolaires de liaison individuels.
Qu'est-ce que le moment dipolaire?
Le moment dipolaire est la séparation des charges électriques. La séparation des charges peut avoir lieu entre deux ions dans une liaison ionique ou deux atomes dans une liaison chimique covalente. Un moment dipolaire survient en raison des différences entre les valeurs d'électronégativité de différents atomes qui forment des liaisons chimiques. Plus la différence entre les valeurs d'électronégativité est grande, le moment dipolaire est élevé. Le moment dipolaire mesure la polarité d'une molécule. Le moment dipolaire d'une molécule est calculé en utilisant l'équation suivante.
μ = σq.r
où μ est le moment dipolaire, q est l'ampleur de la charge et R est la position de charge. Ici, μ et R sont des vecteurs, qui sont des quantités ayant une direction ainsi qu'une ampleur.
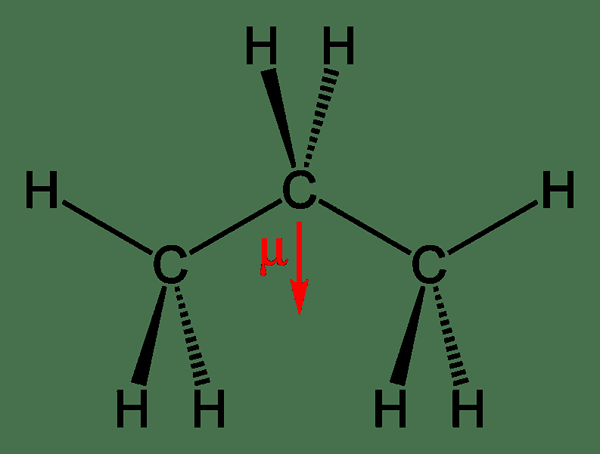
Figure 2: Moment dipolaire du propane
Mais parfois, le terme moment dipolaire est utilisé pour nommer la mesure de la polarité magnétique d'un système de charges. Le moment dipolaire magnétique détermine le couple qu'un aimant éprouve dans un champ magnétique externe. (Couple = moment; une force de rotation).
Quels sont le moment de liaison et le moment dipolaire des similitudes?
- Les deux sont utilisés pour mesurer la polarité (qui est créée en raison de la séparation des charges)
- Les deux sont mesurés dans l'unité Debye (D) qui est égal à Coulomb-Meter (C M).
Quelle est la différence entre le moment de la liaison et le moment dipolaire?
Moment de liaison vs moment dipolaire | |
| Le moment de la liaison est la séparation des charges électriques dans une liaison chimique covalente qui est présente dans un certain composé chimique. | Le moment dipolaire est la séparation des charges électriques. |
| La mesure | |
| Le moment de la liaison mesure la polarité d'une liaison chimique. | Le moment dipolaire mesure la polarité d'une liaison chimique ou d'une molécule. |
| Occurrence | |
| Le moment de liaison se produit dans une liaison chimique covalente. | Le moment dipolaire se produit entre deux ions dans une liaison ionique ou entre deux atomes dans une liaison covalente dans une molécule. |
Résumé - Moment de liaison vs moment dipolaire
Le moment de la liaison et le moment dipolaire sont des termes liés en ce qui concerne la polarité des liaisons chimiques dans les molécules ou les composés ioniques. La principale différence entre le moment de la liaison et le moment dipolaire est que le moment de liaison se produit dans une liaison chimique covalente tandis que le moment dipolaire se produit entre deux ions dans une liaison ionique ou entre deux atomes dans une liaison covalente.
Référence:
1. «Moments dipolaires.”Chemistry LibreTexts, LibreTexts, 16 janvier. 2018, disponible ici.
2. «Moment dipolaire de liaison.»Wikipedia, Wikimedia Foundation, 11 mars. 2018, disponible ici.
Image gracieuseté:
1. «Polarity Boron Trifluoride» par Emma Farmer (Séréphine à Anglais Wikipedia) - Créé avec Adobe Photoshop par Emma Farmer (Domain public) via Commons Wikimedia
2. «Propane-dipole-mont-2d» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


