Différence entre les transposases bactériennes et les intégrases rétrovirales
Différence clé - bactérienne Transposases vs intégrases rétrovirales
Le matériel génétique transportable a évolué avec deux stratégies majeures pour passer d'une région à la région suivante de l'intérieur et entre les génomes. Une méthode consiste à déplacer à travers une molécule d'ARN avant la formation d'une molécule d'ADN tandis que l'autre voie implique des intermédiaires d'ADN. Les transposases et les intégrases virales sont des exemples de ce matériel génétique transposable. Les transposases bactériennes se lient à la fin des transposons et facilitent la catalyse du mouvement du transposon vers une autre partie du génome à travers divers mécanismes. Les intégrases rétrovirales sont des enzymes qui aident à l'intégration du matériel génétique du rétrovirus tel que le VIH dans le matériel génétique (ADN) de la cellule hôte qu'il infecte. C'est le différence clé entre les transposases bactériennes et les intégrases rétrovirales.
CONTENU
1. Aperçu et différence clé
2. Que sont les transposases bactériennes
3. Que sont les intégrases rétrovirales
4. Similitudes entre les transposases bactériennes et les intégrases rétrovirales
5. Comparaison côte à côte - Transposases bactériennes vs intégrases rétrovirales sous forme tabulaire
6. Résumé
Que sont les transposases bactériennes?
La transposase peut être définie comme une enzyme liée à la fin des transposons qui facilitent la catalyse du mouvement du transposon vers une autre partie du génome à travers divers mécanismes. De tels mécanismes incluent le «mécanisme de coupe et de collecte» et «mécanisme de transposition réplicative». La transposase a été introduite pour la première fois par le clonage de l'enzyme qui est nécessaire pour la transposition du transposon TN3. Deux stratégies importantes ont été utilisées par les éléments génétiques transposables pour le déplacement entre les génomes ou d'un site à un autre. Le transport à travers un intermédiaire d'ARN avant la synthèse d'une copie d'ADN est une stratégie tandis que l'autre est lié aux intermédiaires d'ADN seuls. Les réactions de recombinaison qui sont impliquées dans l'intégration des deux éléments se déroulent en raison des enzymes spécifiques aux éléments. Ainsi, dans un cas d'éléments d'ADN, ces enzymes sont appelées transposases tandis que dans un cas d'éléments d'ARN, ils sont appelés intégrases.
En comparant les différences entre les deux stratégies de transposition, le processus d'insertion semble être identique chimiquement. Mais, des preuves récentes propose que certaines similitudes dans le mécanisme d'intégration sont observées dans les régions des séquences d'acides aminés qui forme un site actif; le motif DDE. Cinq familles de transposases sont actuellement classées, mais le nombre de familles n'a pas encore augmenté avec de nouveaux personnages de transposase. Les familles comprennent la transposase DDE, la transposase de tyrosine (Y), la transposase sérine (s), la transposase du cercle de roulement, les transcriptases inverses / endonucléases (RT / EN), etc. Ces familles utilisent des mécanismes catalytiques uniques pour la rupture et la réjouissance de l'ADN. La transposase DDE implique le mécanisme de coupe et de pâte du transposon d'origine et porte trois ensembles d'acides aminés conservés à savoir; aspartate (d), aspartate (d) et glutamate (e). Les transposases de tyrosine impliquent également dans le mécanisme de coupe et de pâte par l'utilisation du résidu tyrosine, qui est spécifique au site.
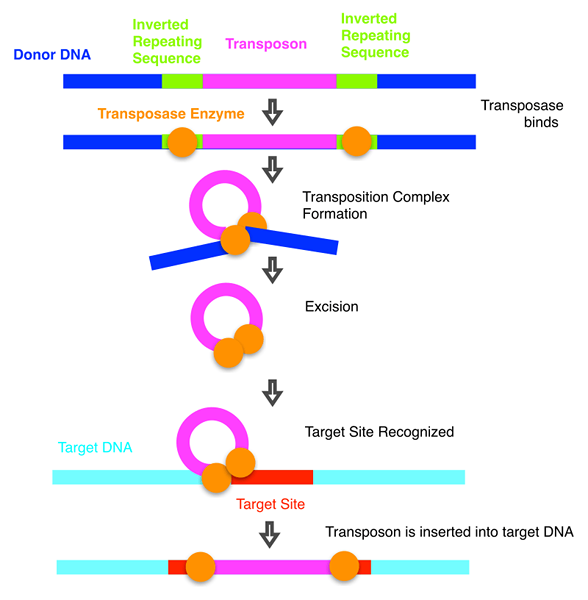
Figure 01: Transposases bactériennes
Les transposases de sérine impliquent un intermédiaire d'ADN circulaire et effectuent le mécanisme de coupe et de collage tout comme les familles ci-dessus. La transposase du cercle de roulement implique dans le mécanisme de copie où un seul brin est directement copié dans le site cible par la réplication de l'ADN. Cela garantit que le brin de modèle et le brin copié ont un brin qui est nouvellement synthétisé. Les transcriptases inverses / la transposase endonucléases ont divers mécanismes de transposition.
Que sont les intégrases rétrovirales?
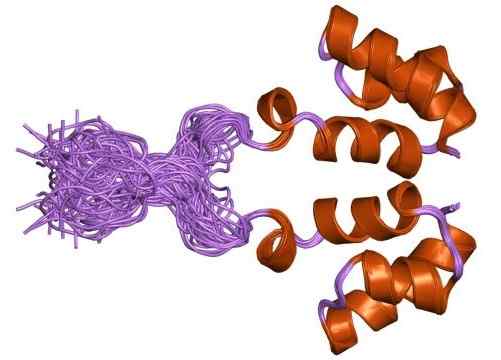
Dans le contexte de l'intégrase rétrovirale, il est considéré comme une enzyme rétrovirale qui aide à l'intégration du matériel génétique du rétrovirus tel que le VIH dans le matériel génétique (ADN) de la cellule qui est infecté. Ces intégrases rétrovirales se confondent le plus souvent avec les intégrases de phage. Les exemples pour les intégrases de phage sont l'intégrase de phage λ. Mais ce sont des enzymes complètement différentes et ne devraient pas être confondus avec. En ce qui concerne la formation du complexe de pré-intégration rétroviral, l'intégrase rétrovirale joue un rôle majeur. Les protéines d'intégrase rétrovirales se composent généralement de trois (03) domaines canoniques. Ces domaines sont connectés par des lieurs flexibles.
Les trois domaines comprennent un domaine de liaison au zinc n terminal où trois faisceaux hélicoïdaux sont connectés et stabilisés par coordination avec l'implication d'un Zn2+ cation, un domaine de noyau catalytique de pli rnase h et un domaine de liaison à l'ADN terminal C, qui est un pli sh3. Par enquête et par des informations biochimiques et structurelles, il suggère que l'intégrase rétrovirale a la capacité de fonctionner comme un dimère de Dimmers (Tetramer). Dans le contexte de la multimérisation et de la liaison à l'ADN viral, les trois domaines de la protéine d'intégrase rétrovirale. La fonction principale de l'intégrase rétrovirale est d'insérer son matériel génétique pour héberger l'ADN. Cette étape est l'étape la plus cruciale dans la réplication virale du virus du VIH. Une fois intégré avec succès, il sera là dans l'ADN chromosomique de la cellule pour le reste de sa durée de vie.

Figure 02: Intégrases rétrovirales
Par conséquent, une fois intégré, il n'y a pas de retour pour la cellule. Ces intégrases rétrovirales impliquent le catalyse de deux réactions majeures, y compris le traitement final de 3 'et la ligature covalente. During 3' end processing, 2-3 nucleotides from both 3' ends of the viral DNA are removed with the intention of revealing the CA dinucleotides of the 3' ends of the viral DNA, and during covalent ligation, the processed 3' ends of L'ADN viral est ligaturé de manière covalente dans l'ADN chromosomique hôte.
Quelle est la similitude entre les transposases bactériennes et les intégrases rétrovirales?
- Les transposases bactériennes et les intégrases rétrovirales ont des séquences d'acides aminés similaires.
Quelle est la différence entre les transposases bactériennes et les intégrases rétrovirales?
Transposases bactériennes vs intégrases rétrovirales | |
| La transposase bactérienne est une enzyme liée à la fin des transposons tout en facilitant la catalyse du mouvement du transposon vers une autre partie du génome à travers divers mécanismes. | Les intégrases rétrovirales sont considérées comme une enzyme rétrovirale qui aide à l'intégration du matériau génétique du rétrovirus tel que le VIH dans le matériau génétique (ADN) de la cellule qui est infecté. |
| Régions contraignantes | |
| Des régions de liaison spécifiques élevées sont nécessaires pour les transposases bactériennes. | Moins ou pas de séquence nucléotidique nécessaire pour la liaison. |
Résumé - Bactérien Transposases vs intégrases rétrovirales
Les transposases bactériennes sont considérées comme une enzyme rétrovirale qui aide à l'intégration du matériel génétique du rétrovirus tel que le VIH dans le matériel génétique (ADN) de la cellule qui est infecté. Deux stratégies importantes ont été utilisées par les éléments génétiques transposables pour le déplacement entre les génomes ou d'un site à un autre. Cinq familles de transposases sont actuellement classées, mais le nombre de familles n'a pas encore augmenté avec de nouveaux personnages de transposase. Intégrase rétrovirale, elle est considérée comme une enzyme rétrovirale qui aide à l'intégration du matériel génétique du rétrovirus tel que le VIH dans le matériel génétique (ADN) de la cellule infectée. Les protéines d'intégrase rétrovirales se composent généralement de trois (03) domaines canoniques. La fonction principale de l'intégrase rétrovirale est d'insérer son matériel génétique pour héberger l'ADN. Cette étape est l'étape la plus cruciale dans la réplication virale du virus du VIH. Par conséquent, une fois intégré, il n'y a pas de retour pour la cellule. C'est la différence entre les transposases bactériennes et l'intégrase rétrovirale.
Téléchargez le PDF des transposases bactériennes par rapport aux intégrases rétrovirales
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici: différence entre les transposases bactériennes et les intégrases rétrovirales
Référence:
1.Vigil-Stenman, Theoden, et al. «Abondance élevée et expression des transposases dans les bactéries de la mer Baltique.”The Isme Journal, Vol. 11, non. 11, 2017, pp. 2611-2623., doi: 10.1038 / Ismej.2017.114.
2.Polard, P et M Chandler. «Transposases bactériennes et intégrases rétrovirales.«Microbiologie moléculaire., U.S. Bibliothèque nationale de médecine, Jan. 1995. Disponible ici
3.Andrake, Mark D., et Anna Marie Skalka. «Intégrase rétrovirale: alors et maintenant.»Revue annuelle de la virologie, Vol. 2, non. 1 sept. 2015, pp. 241-264., doi: 10.1146 / Annurev-Virology-100114-055043.
Image gracieuseté:
1.'Mécanisme de coupe et de collage de la transposition' par Alana Gyemi, (CC By-Sa 4.0) via Commons Wikimedia
2.'PDB 1WJD EBI'BY JAWAHAR SWAMINATHAN et MSD au European Bioinformatics Institute (Domain public) via Commons Wikimedia


