Différence entre la distillation azéotrope et extractive
Différence clé - azéotrope vs Extractif Distillation
Le différence clé entre la distillation azéotrope et extractive est que en distillation azéotrope, La formation d'un azéotrope est nécessaire pour séparer les composants d'un mélange alors qu'en distillation extractive, aucune formation d'azéotrope n'a lieu.
La distillation est le processus de purification d'un liquide par un processus de chauffage et de refroidissement. Dans la distillation azéotrope, un azéotrope se forme avant la séparation des composants d'un mélange. Un azéotrope est un mélange de composants ayant un point d'ébullition constant. Dans le processus de distillation extractive, il n'est pas nécessaire de former un azéotrope. Dans cette méthode, un troisième composant est ajouté à un mélange binaire. Ce troisième composant peut affecter la volatilité des composants existants.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la distillation azéotrope
3. Qu'est-ce que la distillation extractive
4. Comparaison côte à côte - distillation azéotrope vs extractive sous forme tabulaire
5. Résumé
Qu'est-ce que la distillation azéotrope?
La distillation azéotrope est une technique de séparation utilisée pour séparer les composants d'un mélange en formant un azéotrope. Les azéotropes sont des mélanges de composants avec un point d'ébullition constant. Ce type de mélange ne peut pas être séparé en composants par une simple distillation car tous les composants ont le même point d'ébullition. Lorsqu'un mélange azéotrope est bouilli, la proportion de composants dans le liquide et sa phase de vapeur est égale.
Dans la méthode de distillation azéotrope, un nouveau composant (connu sous le nom de l'entraîneur) est ajouté au mélange azéotrope afin de former un nouvel azéotrope qui bout à une température plus basse que l'azéotrope existante. Ensuite, le système a deux phases liquides non miscibles avec des points d'ébullition différents (hétérogènes).

Figure 01: Le système de séparation de l'éthanol (E) de l'eau (W) en utilisant du benzène (b)
Par exemple, considérons un mélange d'éthanol et d'eau. Il est connu comme un azéotrope binaire Parce qu'il y a deux composants miscibles dans le mélange. Si le benzène est ajouté comme entraîneur à ce mélange, il peut affecter la volatilité des autres composants dans le mélange. Le mélange est maintenant appelé azéotrope tertiaire car il y a trois composants dans le mélange. Lorsque ce mélange est distillé, il est connu sous le nom de distillation azéotrope.
Qu'est-ce que la distillation extractive?
La distillation extractive est une technique de séparation qui inclut l'ajout d'un troisième composant à un mélange binaire pour permettre la séparation des deux composants. Cependant, le troisième composant ne se vaporise pas pendant le processus de distillation; le troisième composant doit être moins volatil. Ou bien, il devrait avoir un point d'ébullition plus élevé.
Si le mélange binaire a deux composants avec des points d'ébullition relativement similaires, ces composants ne peuvent pas être séparés par une simple distillation. Cela se produit car les deux composants seront vaporisés à des températures presque similaires (mauvaise résolution).
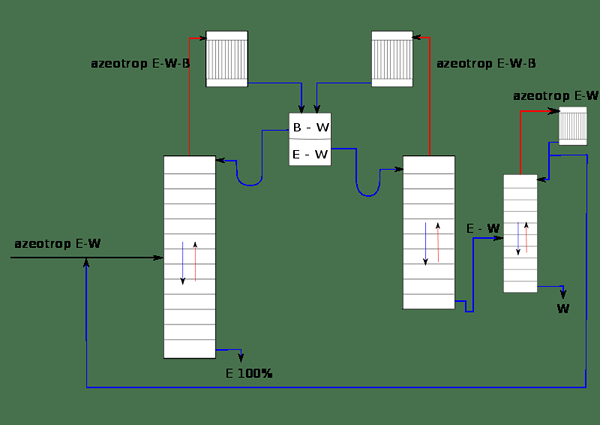
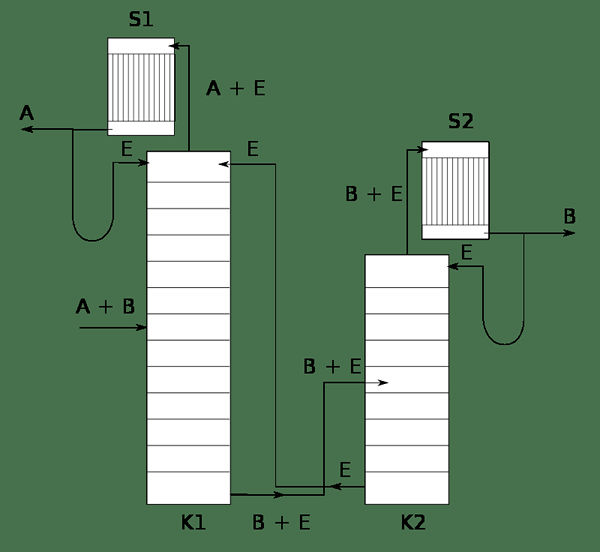
Figure 02: Un système montrant la distillation extractive du mélange A et B à l'aide de solvant E
Pendant le processus de distillation extractive, un azéotrope n'est pas formé. Le processus implique un solvant avec une très faible volatilité comme solvant du mélange de composants. Il est connu comme le solvant de séparation. Pendant la distillation, le composant avec une volatilité la plus élevée sera facilement vaporisé en tant que produit supérieur. Le reste est le solvant et l'autre composant (dans le mélange binaire). Étant donné que le solvant ne forme pas un azéotrope avec le deuxième composant, il peut également être séparé facilement avec une méthode disponible.
Par exemple, l'extraction du toluène de la paraffine peut être effectuée dans une méthode de distillation extractive. Le mélange de toluène et d'iso-octane a des poids moléculaires presque similaires. Par conséquent, la séparation du toluène de ce mélange est très difficile. Mais lorsque du phénol est ajouté à ce mélange, le point d'ébullition de l'iso-octane augmente. Cela facilite la séparation du toluène de ce mélange.
Quelle est la différence entre la distillation azéotrope et extractive?
Distillation azéotrope vs extractive | |
| La distillation azéotrope est une technique de séparation utilisée pour séparer les composants d'un mélange en formant un azéotrope. | La distillation extractive est une technique de séparation qui inclut l'ajout d'un troisième composant à un mélange binaire pour permettre la séparation des deux composants. |
| Technique | |
| Dans la technique de distillation azéotrope, la formation d'un azéotrope avant la distillation est importante. | Dans la technique de distillation extractive, un composant non volatile est ajouté au mélange qui peut affecter la volatilité des composants dans le mélange. |
| Séparation | |
| La distillation azéotrope sépare un composant en phase de vapeur qui a la même composition chimique que dans la phase liquide. | La distillation extractive sépare un composant d'une matrice de substances. |
Résumé - Azéotrope vs Extractif Distillation
La distillation est une technique chimique utilisée pour la séparation des différents composants dans un mélange. Il existe de nombreux types de techniques de distillation, la distillation simple étant le type le plus simple. La distillation azéotrope et la distillation extractive sont deux types importants de distillation. La différence entre la distillation azéotrope et extractive est que la formation d'un azéotrope est nécessaire pour séparer les composants d'un mélange alors qu'en distillation extractive, aucune formation d'azéotrope n'a lieu.
Référence:
1. «Distillation azéotrope.»Wikipedia, Wikimedia Foundation, 4 avril. 2018. Disponible ici
2. «Distillation extractive.»Wikipedia, Wikimedia Foundation, 14 janvier. 2018. Disponible ici
3. «Azéotrope.»Wikipedia, Wikimedia Foundation, 8 avril. 2018. Disponible ici
Image gracieuseté:
1.'Distil Extract' par Joanna Kośmider - Propre travaux, (domaine public) via Commons Wikimedia
2.'Azeotr distill2'By Joanna Kośmider - Propre travaux, (domaine public) via Commons Wikimedia


