Différence entre antibondants et sans liaison
Le différence clé entre les antibondants et le non-liaison est que Les orbitales antibondants augmentent l'énergie d'une molécule tandis que les orbitales sans liaison ne changent pas l'énergie d'une molécule.
Les termes anticonding et sans liaison relèvent de la théorie orbitale moléculaire. Selon cette théorie, ces orbitales sont des orbitales hybrides qui se forment en raison du chevauchement d'autres orbitales.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que les antibondants
3. Qu'est-ce que le non-liaison
4. Comparaison côte à côte - antibonding vs non-liaison sous forme tabulaire
5. Résumé
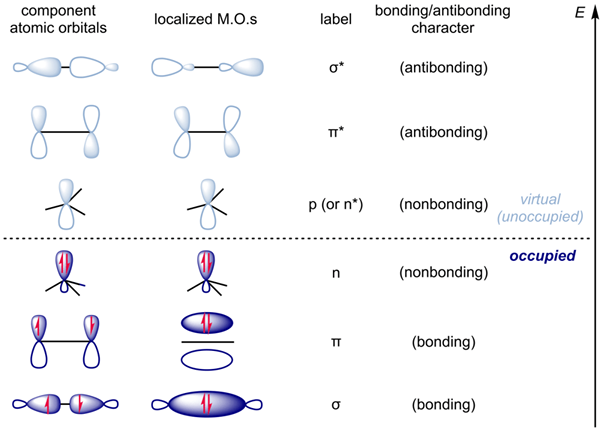
Qu'est-ce que les antibondants?
Les orbitales moléculaires antibondantes sont des orbitales contenant des électrons à l'extérieur de la région entre deux noyaux atomiques. Les électrons dans les orbitales antibondants réduisent la stabilité d'une molécule car ces électrons passent la plupart de leur temps en dehors des noyaux atomiques. Par conséquent, la densité électronique des orbitales moléculaires antibondantes est moindre par rapport aux orbitales moléculaires de liaison, et les orbitales moléculaires antibondantes indiquent la densité électronique à l'extérieur de la liaison.
Les orbitales moléculaires antibondantes ont une énergie plus élevée que celle des orbitales atomiques et des orbitales moléculaires de liaison. En effet, les électrons de ces orbitales ne contribuent pas à la réduction de la répulsion entre deux noyaux atomiques. Par conséquent, la stabilité des composés ayant des électrons dans les orbitales moléculaires anti-adorables est plus faible. Cependant, dans des composés stables, la présence d'électrons dans les orbitales moléculaires anti-aléatoires n'est pas ou moins. De plus, la disposition spatiale des orbitales moléculaires anti-obligation ne détermine pas la forme ou la géométrie d'une molécule.

Selon l'image ci-dessus, la densité d'électrons dans l'orbitale moléculaire de liaison est égale à celle de l'orbital moléculaire anticondien. Par conséquent, c'est une molécule très instable. Par conséquent, la molécule He2 n'existe pas. L'orbitale moléculaire anti-adhérent est donnée comme σ *.
Qu'est-ce que le non-liaison?
L'orbite sans liaison est l'orbitale moléculaire dans laquelle l'addition ou l'élimination des électrons n'augmente ni ne diminue l'ordre de liaison entre les atomes. Nous désignons souvent cette orbitale par «n». Ces orbitales ressemblent aux paires d'électrons solitaires dans les structures de Lewis.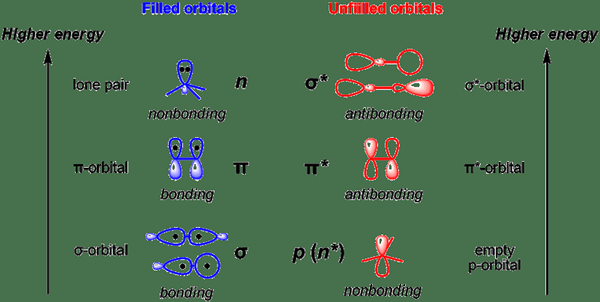
En outre, l'énergie d'une orbite sans liaison se situe entre l'énergie orbitale antibondante et l'orbitale de liaison.
Quelle est la différence entre les antibondants et les non-liaisons?
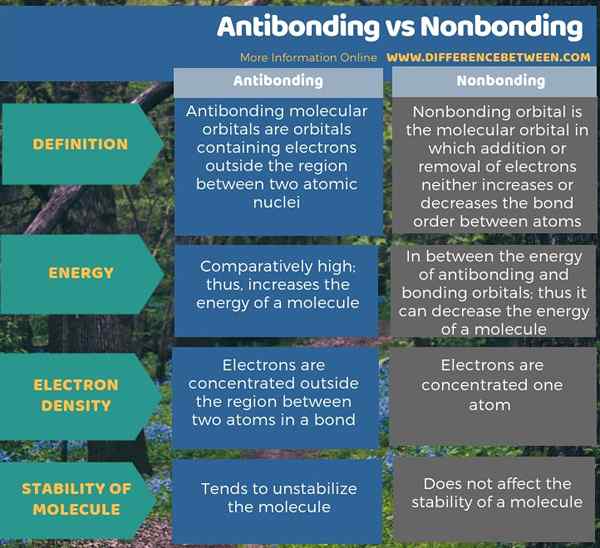
Les orbitales antibondantes et sans liaison sont des orbitales moléculaires. La principale différence entre les antibondants et les non-liaisons est que les orbitales antibondantes augmentent l'énergie d'une molécule tandis que les orbitales sans liaison ne changent pas l'énergie d'une molécule. En outre, la présence d'orbitales antibondantes a tendance à ne pas stabiliser la molécule tandis que les orbitales sans liaison n'ont aucun effet sur la stabilité de la molécule.
Résumé - Antibondant vs non-liaison
Les orbitales antibondantes et sans liaison sont des orbitales moléculaires. La principale différence entre les antibondants et les non-liaisons est que les orbitales antibondantes augmentent l'énergie d'une molécule tandis que les orbitales sans liaison ne changent pas l'énergie d'une molécule.
Référence:
1. Helmenstine, Anne Marie. «Définition orbitale anticonteuse."Thoughtco, juil. 3, 2019, disponible ici.
Image gracieuseté:
1. «MOS localisés» par Alsosaid1987 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Cartoon Localized Molecular Orbitals» par ALSOSAID1987 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


