Différence entre le sulfate d'ammonium et le sulfate de sodium
Le différence clé entre le sulfate d'ammonium et le sulfate de sodium est que Le sulfate d'ammonium a une odeur piquante et irritante, tandis que le sulfate de sodium est une substance inodore.
Le sulfate d'ammonium et le sulfate de sodium contiennent des anions de sulfate liés à différents cations: cation ammonium et cation sodium. Par conséquent, ces substances ont des propriétés chimiques et physiques différentes, ainsi que.
Mots clés
1. Aperçu et différence clé
2. Qu'est-ce que le sulfate d'ammonium
3. Qu'est-ce que le sulfate de sodium
4. Comparaison côte à côte - sulfate d'ammonium vs sulfate de sodium sous forme tabulaire
6. Résumé
Qu'est-ce que le sulfate d'ammonium?
Le sulfate d'ammonium est un composé inorganique ayant la formule chimique (NH4)2DONC4. Cette substance contient un cation ammonium lié à un anion sulfate. Par conséquent, il a deux cations d'ammonium par anion sulfate. Nous pouvons nommer cette substance comme un sel inorganique de sulfate avec de nombreuses utilisations importantes.
La masse molaire du sulfate d'ammonium est 132.14 g / mol. Ce composé apparaît comme des granules ou des cristaux hygroscopiques fins. De plus, le point de fusion de ce composé peut aller de 235 à 280 ° C; Au-dessus de cette plage de température, le composé a tendance à se décomposer. Nous pouvons produire un composé de sulfate d'ammonium en traitant de l'ammoniac avec de l'acide sulfurique. Pour cette préparation, nous pouvons utiliser un mélange de gaz d'ammoniac et de vapeur d'eau dans un réacteur. De plus, nous devons ajouter de l'acide sulfurique concentré dans ce réacteur, puis la réaction entre ces composants formera le sulfate d'ammonium.
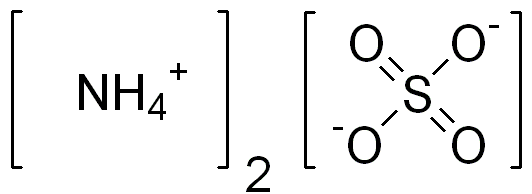
Figure 01: Structure chimique du sulfate d'ammonium
Lorsque vous envisagez les applications du sulfate d'ammonium, nous pouvons l'utiliser comme engrais principalement pour les sols alcalins. De plus, nous pouvons l'utiliser dans la production d'insecticides, d'herbicides, de fongicides, etc. En plus de ceux-ci, nous utilisons ce composé pour la purification des protéines via les précipitations dans le laboratoire de biochimie. Il est également utile comme additif alimentaire.
Qu'est-ce que le sulfate de sodium?
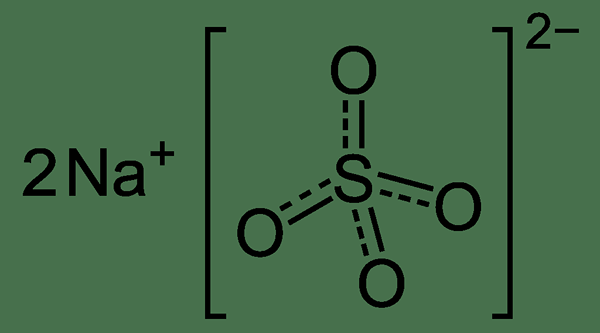
Le sulfate de sodium est un composé inorganique ayant la formule chimique2DONC4. Ce composé a plusieurs formes hydratées. Parmi eux, la forme hydrate la plus courante est la forme de décahydrate. Toutes les formes anhydres et hydratées se produisent sous forme de solides cristallins blancs. De plus, le sulfate de sodium est hygroscopique.

Figure 02: Structure chimique du sulfate de sodium
La masse molaire de sulfate de sodium est 142.04 g / mol (forme anhydre). Il est sans odeur, et le point de fusion et les points d'ébullition sont de 884 ° C et 1 429 ° C. Par conséquent, cette substance peut avoir des structures cristallines orthorhombiques ou hexagonales. Plus important encore, le sulfate de sodium est très stable. Il n'est pas réactif envers de nombreux agents oxydants et réducteurs. Cependant, à des températures élevées, la substance peut se convertir en sulfure de sodium par réduction carbothermique.
En dehors de cela, ce composé est un sel neutre. Par conséquent, la solution aqueuse de ce composé a un pH de 7. En plus de cela, ce composé peut réagir avec de l'acide sulfurique donnant au sel d'acide le bisulfate de sodium. Lorsque vous envisagez les applications de ce composé, le formulaire Decahydrate est utile dans la fabrication de détergents et de nombreux autres produits. De plus, il est important dans le processus de Kraft et la pulpe de papier.
Quelle est la différence entre le sulfate d'ammonium et le sulfate de sodium?
Le sulfate d'ammonium et le sulfate de sodium contiennent des cations et des anions liés les uns aux autres; cation ammonium lié à l'anion sulfate et cation sodium lié à l'anion sulfate. Si on nous donne deux échantillons de ces composés, nous pouvons facilement les distinguer entre eux en sentant leur odeur. La principale différence entre le sulfate d'ammonium et le sulfate de sodium est que le sulfate d'ammonium a une odeur piquante et irritante, tandis que le sulfate de sodium est une substance inodore.
L'infographie ci-dessous montre les différences entre le sulfate d'ammonium et le sulfate de sodium sous forme tabulaire pour une comparaison côte à côte.

Résumé - sulfate d'ammonium vs sulfate de sodium
Si on nous donne deux échantillons de sulfate d'ammonium et de composés de sulfate de sodium, nous pouvons facilement les distinguer entre eux en sentant leur odeur. La principale différence entre le sulfate d'ammonium et le sulfate de sodium est que le sulfate d'ammonium a une odeur piquante et irritante, tandis que le sulfate de sodium est une substance inodore.
Référence:
1. "Sulfate d'ammonium." Wikipédia, Fondation Wikimedia, 21 février. 2021, disponible ici.
Image gracieuseté
1. «Sodium Sulfate» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia
2. «Sulfate d'ammonium» par Edgar181 - Propre travaux (domaine public) via Commons Wikimedia


