Différence entre les amines aliphatiques et aromatiques
Amines aliphatiques vs aromatiques
La meilleure différence et la plus significative entre les amines aliphatiques et aromatiques est la différence structurelle entre les deux composés. Les amines aliphatiques sont les composés aminés dans lesquels l'azote est lié aux groupes alkyle uniquement, et les amines aromatiques sont les composés amine dans lesquels l'azote est lié à au moins l'un des groupes aryle. Cette différence structurelle conduit à toutes les autres différences dans leurs propriétés telles que la réactivité, l'acidité et la stabilité.
Que sont les amines aliphatiques?
En amines aliphatiques, L'azote est directement lié aux groupes alkyle et aux atomes d'hydrogène. Le nombre de groupes alkyles varie de un à trois. Selon le nombre de groupes alkyle attachés, ils sont appelés «amines primaires»(Un seul groupe alkyle -1o), «amines secondaires»(Deux groupes alkyles - 2o), et "amines tertiaires»(Trois groupes alkyles - 3o).
Toutes les amines aliphatiques sont des bases faibles comme l'ammoniac, mais ce sont des bases légèrement plus fortes que l'ammoniac. Ils ont tous presque la même force de base de PKB = 3-4. La basité augmente à mesure que les groupes d'hydrogène sur l'atome d'azote sont remplacés par des groupes alkyle. Les amines tertiaires sont plus fondamentales que les amines primaires et secondaires.
Lorsque l'azote est l'un des atomes d'un anneau, ils sont appelés amines hétérocycliques. La pipéridine et la pyrollidine sont deux exemples pour les amines hétérocycliques aliphatiques.
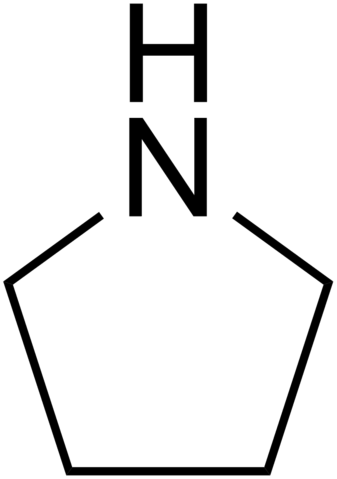
Pyrollidine
Que sont les amines aromatiques?
Dans les amines aromatiques, L'azote est directement attaché à au moins un anneau de benzène. Selon le nombre de groupes attachés à l'atome d'azote, ils sont classés comme des amines «primaires», «secondaires» et «tertiaires». "Aryl amines"Est un autre nom pour les amines aromatiques. Semblables aux amines aliphatiques, les amines aromatiques primaires et secondaires peuvent former des liaisons hydrogène intermoléculaires. Par conséquent, les points d'ébullition des amines primaires et secondaires sont relativement plus élevés que les amines tertiaires.
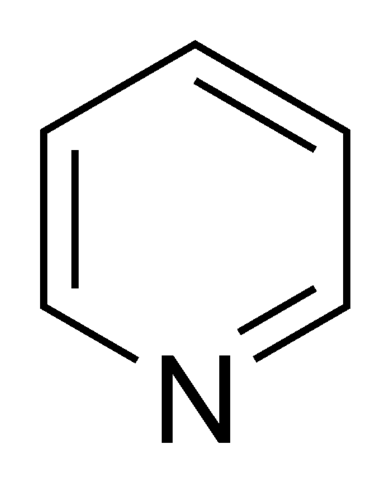
Il y a amines aromatiques hétérocycliques; Pyrrole et Pyrydine sont deux exemples pour eux.

Pyrydine
Quelle est la différence entre les amines aliphatiques et aromatiques?
• Structure:
• Les alkyl amines ne contiennent pas de bagues de benzène qui sont directement attachées à l'atome d'azote.
• Mais, dans les amines aromatiques, il y a au moins un anneau de benzène directement attaché à l'atome d'azote.
• Les amines aliphatiques peuvent avoir des anneaux aromatiques tant que l'azote est directement attaché à un atome de carbone.
• Basicité:
• Les amines aliphatiques sont des bases plus fortes que les amines aromatiques. Cela est essentiellement dû à la stabilité du cation qui se forme après l'ionisation. En d'autres termes, les ions alkyl ammonium sont plus stables que les ions aryl ammonium. Parce que les groupes alkyles sont des groupes de libération d'électrons et donc de délocaliser partiellement la charge positive sur l'atome d'azote.

• Les amines hétérocycliques aliphatiques sont également des bases plus fortes que les amines hétérocycliques aromatiques.
• Exemples
• Des exemples d'amines hétérocycliques aliphatiques sont la pipéridine et la pyrollidine.
• Des exemples d'amines aromatiques hétérocycliques sont le pyrrole et la pyrydine.
Images gracieuseté: pyrollidine et pyridine via Wikicommons (domaine public)


