Différence entre l'énergie d'activation et l'énergie seuil
Le différence clé entre l'énergie d'activation et l'énergie seuil est que le L'énergie d'activation décrit la différence d'énergie potentielle entre les réactifs et le complexe activé tandis que l'énergie seuil décrit l'énergie requise par les réactifs pour colliter les uns avec les autres pour former le complexe activé.
L'énergie est la capacité de travailler. S'il y a suffisamment d'énergie, nous pouvons utiliser cette énergie pour faire un certain travail que nous désirons; En chimie, ce travail peut être une réaction chimique ou une réaction nucléaire. L'énergie d'activation et l'énergie seuil sont deux termes que nous utilisons en chimie pour définir deux formes d'énergie différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie d'activation
3. Qu'est-ce que l'énergie seuil
4. Comparaison côte à côte - énergie d'activation vs énergie seuil sous forme tabulaire
5. Résumé
Qu'est-ce que l'énergie d'activation?
L'énergie d'activation est une forme d'énergie dont nous avons besoin pour activer une réaction chimique ou nucléaire ou toute autre réaction. La plupart du temps, nous mesurons cette forme d'énergie dans l'unité kilojoules par mole (kj / mol). Cette forme d'énergie est la barrière d'énergie potentielle qui évite une réaction chimique de progresser. Cela signifie qu'il empêche les réactifs de se convertir en produits. De plus, afin de progresser une réaction chimique dans un système thermodynamique, le système doit atteindre une température élevée qui est suffisante pour fournir aux réactifs une énergie qui est égale ou supérieure à la barrière d'énergie d'activation.

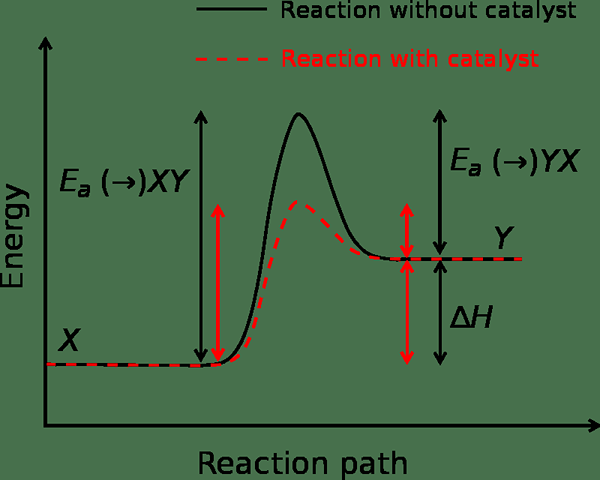
Figure 01: Rate de réaction en l'absence et en présence d'un catalyseur
Si le système obtient suffisamment d'énergie, alors la vitesse de réaction augmente. Cependant, dans certains cas, la vitesse de réaction diminue lorsque nous augmentons la température. Cela est dû à l'énergie d'activation négative. Nous pouvons calculer la vitesse de réaction et l'énergie d'activation en utilisant l'équation d'Arrhenius. C'est comme suit:
K = ae-Eun/ (RT)
Où k est le coefficient de vitesse de réaction, a est le facteur de fréquence de la réaction, r est la constante de gaz universelle et t est la température absolue. Alors eun est l'énergie d'activation.
En plus de cela, les catalyseurs sont des substances qui peuvent abaisser la barrière d'énergie d'activation pour une réaction. Il le fait en modifiant l'état de transition de la réaction. De plus, la réaction ne consomme pas le catalyseur lors de la progression de la réaction.
Qu'est-ce que l'énergie seuil?
L'énergie seuil est l'énergie minimale qu'une paire de particules doit avoir pour subir une collision réussie. Ce terme est très utile en physique des particules plutôt qu'en chimie. Ici, nous parlons de l'énergie cinétique des particules. Cette collision de particules forme le complexe activé (intermédiaire) d'une réaction. Par conséquent, l'énergie seuil équivaut à la somme de l'énergie cinétique et de l'énergie d'activation. Par conséquent, cette forme d'énergie est toujours égale ou supérieure à l'énergie d'activation.
Quelle est la différence entre l'énergie d'activation et l'énergie seuil?
L'énergie d'activation est une forme d'énergie dont nous avons besoin pour activer une réaction chimique ou nucléaire ou toute autre réaction. Il décrit la différence d'énergie potentielle entre les réactifs et le complexe activé. De plus, sa valeur est toujours égale ou inférieure à l'énergie seuil du même système thermodynamique. L'énergie seuil, en revanche, est l'énergie minimale qu'une paire de particules doit avoir pour subir une collision réussie. Il décrit l'énergie requise par les réactifs pour entrer en collision les uns avec les autres pour former le complexe activé. En plus de cela, la valeur de cette énergie est toujours égale ou supérieure à l'énergie d'activation du même système thermodynamique. L'infographie ci-dessous présente la différence entre l'énergie d'activation et l'énergie seuil sous forme tabulaire.
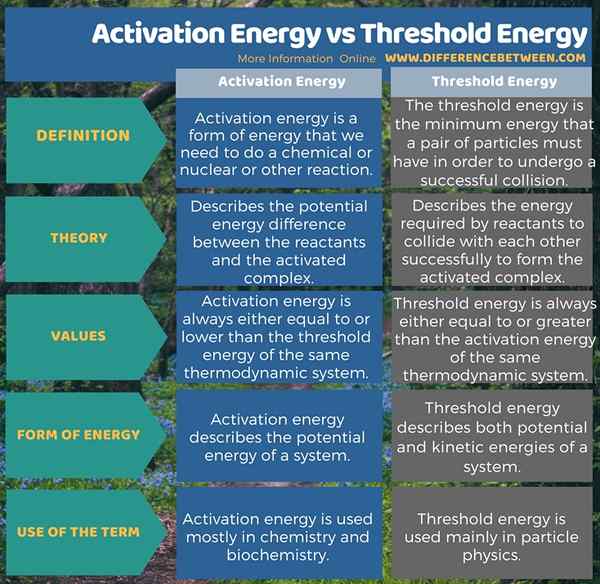
Résumé - Énergie d'activation vs énergie seuil
Nous pouvons définir à la fois l'énergie seuil et l'énergie d'activation pour un système thermodynamique. La principale différence entre l'énergie d'activation et l'énergie seuil est que l'énergie d'activation décrit la différence d'énergie potentielle entre les réactifs et le complexe activé tandis que l'énergie seuil décrit l'énergie requise par les réactifs pour colliter les uns avec les autres pour former le complexe activé.
Référence:
1. «Énergie d'activation.»Wikipedia, Wikimedia Foundation, 27 juillet 2018. Disponible ici
2. «Énergie seuil.”Wikipedia, Wikimedia Foundation, 9 août. 2018. Disponible ici
Image gracieuseté:
1.«Énergie d'activation» (domaine public) via Commons Wikimedia


