Différence entre l'acide et la base
La principale différence entre l'acide et la base est que Les acides ont des valeurs de pH allant de 1 à 7 tandis que les bases ont des valeurs de pH allant de 7 à 14.
La valeur de pH est le logus logarithme de H+ concentration en ions. pH 7 est considéré comme le pH neutre. Les valeurs de pH supérieures à 7 indiquent la présence d'une base tandis que les valeurs inférieures à 7 indiquent la présence d'acides. Selon la théorie de Brønsted-Lowry, les acides peuvent libérer H+ ions tandis que les bases peuvent accepter h+ ions.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un acide
3. Qu'est-ce qu'une base
4. Comparaison côte à côte - acide vs base sous forme tabulaire
5. Résumé
Qu'est-ce qu'un acide?
Les acides sont des substances ayant un pH inférieur à 7 dans leur solution aqueuse. La présence d'un milieu acide peut être déterminée à l'aide de papiers décisifs. Les acides peuvent devenir un tournesol bleu. Cependant, il n'y a pas de changement de couleur si le tournesol rouge est utilisé. Les composés ayant des atomes d'hydrogène facilement ionisables sont souvent des acides.
Selon la théorie de Brønsted-Lowry, un acide est une substance qui peut libérer des protons (H+ ions) au milieu lorsqu'il est dans un milieu aqueux. Quand h+ Les ions sont libérés, ces ions ne peuvent pas exister seuls dans le milieu aqueux. Par conséquent, ces ions se combinent avec des molécules d'eau, formant H3O+ ions (ions hydronium). La présence d'ions hydronium indique ainsi la présence d'un acide.
Selon la théorie d'Arrhenius, un acide est une substance qui peut augmenter la quantité d'ions hydronium dans un milieu aqueux. Cela se produit en raison de l'augmentation de H+ ions. En d'autres termes, les acides libèrent h+ ions, qui peuvent interagir avec les molécules d'eau pour former des ions hydronium.
Lorsque vous envisagez la théorie de Lewis, un acide est un composé capable d'accepter une paire d'électrons d'une liaison chimique covalente. Sur la base de cette définition, les substances qui n'ont pas d'atomes d'hydrogène sont également classées comme des acides en raison de leur capacité à accepter les paires d'électrons.
Propriétés d'un acide
Un acide a généralement un goût aigre. Le pH d'un acide est toujours inférieur à 7. Presque tous les acides ont une odeur brûlante. La texture d'un acide est collante plutôt que glissante. De plus, les acides peuvent réagir avec des métaux (même des métaux très peu réactives) pour former l'hydrure métallique et l'hydrogène gazeux.
Qu'est-ce qu'une base?
Une base est une substance qui montre une valeur de pH supérieure à 7 lorsqu'elle est dans une solution aqueuse. La basicité d'une solution fait que la couleur du tournesol rouge se transforme en couleur bleue. Par conséquent, la présence d'une base peut être déterminée en utilisant un tournesol rouge. Cependant, lorsque le tournesol bleu est utilisé, il n'y a pas de changement de couleur avec une base. Les composés ayant des groupes hydroxyles facilement ionisables sont souvent des bases.
Selon la théorie de Brønsted-Lowry, une base est un accepteur de protons; En d'autres termes, une base peut accepter des protons d'un milieu aqueux. Cependant, la théorie d'Arrhenius donne également une définition similaire: une base est une substance qui diminue la quantité d'ions hydronium présents dans un milieu. La concentration d'ions hydronium est diminuée car la base obtient H+ ions ou protons du milieu aqueux. Ces ions sont nécessaires pour la formation d'ions hydronium.

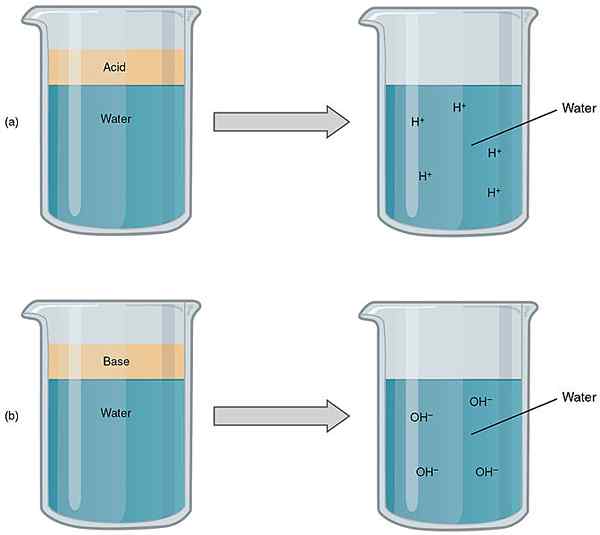
Figure 1: Comparaison des acides et des bases
Lorsque vous envisagez la théorie de Lewis, une base est une substance qui peut donner des paires d'électrons. Ces substances donnent des paires d'électrons et forment des liaisons covalentes coordonnées. Selon cette théorie, la plupart des composés qui n'ont pas de groupes oh deviennent des bases.
Propriétés d'une base
Les bases ont un goût amer. Ces substances montrent toujours des valeurs de pH supérieures à 7. Presque toutes les bases sont inodores, à l'exception de l'ammoniac. L'ammoniac a une odeur piquante. Contrairement aux acides, les bases se sentent glissantes. Les bases sont neutralisées lorsqu'elles ont réagi avec les acides.
Quelle est la différence entre l'acide et la base?
Acide vs base | |
| Un acide est une substance qui montre une valeur de pH inférieure à 7 lorsqu'elle est dans une solution aqueuse | Une base est une substance qui montre une valeur de pH supérieure à 7 lorsqu'elle est dans une solution aqueuse |
| Définition basée sur la théorie de Brønsted-Lowry | |
| Un acide est une substance qui peut libérer des protons (ions H +) sur le milieu lorsqu'il est dans un milieu aqueux. | Une base est un accepteur de protons; En d'autres termes, une base peut accepter des protons d'un milieu aqueux. |
| Définition basée sur la théorie de l'Arrhenius | |
| Un acide est une substance qui peut augmenter la quantité d'ions hydronium dans un milieu aqueux. | Une base est une substance qui peut diminuer la quantité d'ions hydronium dans un milieu aqueux. |
| Définition basée sur la théorie de Lewis | |
| Un acide est un composé capable d'accepter une paire d'électrons d'une liaison chimique covalente. | Une base est une substance qui peut donner des paires d'électrons. |
| Changement de couleur dans le tournesol | |
| Les acides peuvent devenir un tournesol bleu, mais il n'y a pas de changement de couleur dans le tournesol rouge. | Les bases peuvent devenir bleu rouge rouge, mais il n'y a pas de changement de couleur dans le tournesol bleu. |
| Goût | |
| Le sida a un goût aigre. | Les bases ont un goût amer. |
| Odeur | |
| Les acides ont une odeur brûlante. | Les bases sont sans odeur, à l'exception de l'ammoniac. |
| Ionisation | |
| Les acides peuvent former des ions hydronium lorsqu'ils sont ionisés. | Les bases peuvent former des ions hydroxyles lorsqu'ils sont ionisés. |
| Espèces chimiques conjuguées | |
| L'espèce conjuguée d'un acide est sa base conjuguée. | L'espèce conjuguée d'une base est son acide conjugué. |
| Neutralisation | |
| Un acide peut être neutralisé à l'aide d'une base. | Une base peut être neutralisée à l'aide d'un acide. |
| Titrage | |
| Les acides sont titrés avec des bases pour la neutralisation. | Les bases sont réagies avec les acides pour la neutralisation. |
Résumé - Acid vs base
Tous les composés peuvent être classés en acides, bases et composés neutres. La principale différence entre l'acide et la base est que les acides ont des valeurs de pH allant de 1 à 7 tandis que les bases ont des valeurs de pH allant de 7 à 14.
Référence:
1. Helmenstine, Anne Marie. «Voici ce qu'est un acide en chimie.”Thoughtco, disponible ici.
2. Helmenstine, Anne Marie. «Les acides clés et les bases définitions.”Thoughtco, disponible ici.
3. LibreTexts. «Aperçu des acides et des bases.”Chemistry LibreTexts, LibreTexts, 13 février. 2017, disponible ici.
Image gracieuseté:
1. «215 Acids and Bases-01» par OpenStax College - Anatomy & Physiology, Connexions Web Site, 19 juin 2013 (CC par 3.0) via Commons Wikimedia


